摘要
与人类血液恶性肿瘤和小鼠实体瘤相比,人类实体瘤的有效CAR-T细胞递送率较低,这可能部分解释了这些不同的结果。
我们使用人类和啮齿动物循环系统的解剖学和生理学数据来计算健康和肿瘤组织的典型灌注,并估计不同器官、肿瘤类型和物种的免疫细胞递送速率上限。估计小鼠的最大递送率比人类高10000倍,但据报道,小鼠的CAR-T细胞剂量通常仅低10-100倍,这表明临床试验中CAR-T细胞进入肿瘤的有效递送率远低于相应的小鼠模型。
结果表明,可能需要更高的有效人类剂量来驱动与小鼠实体瘤模型相当的功效,并且应在小鼠中测试较低剂量。我们认为,物种的定量以及工程T细胞的器官特异性递送和归巢将是释放其实体瘤潜力的关键。
方法
模型简介
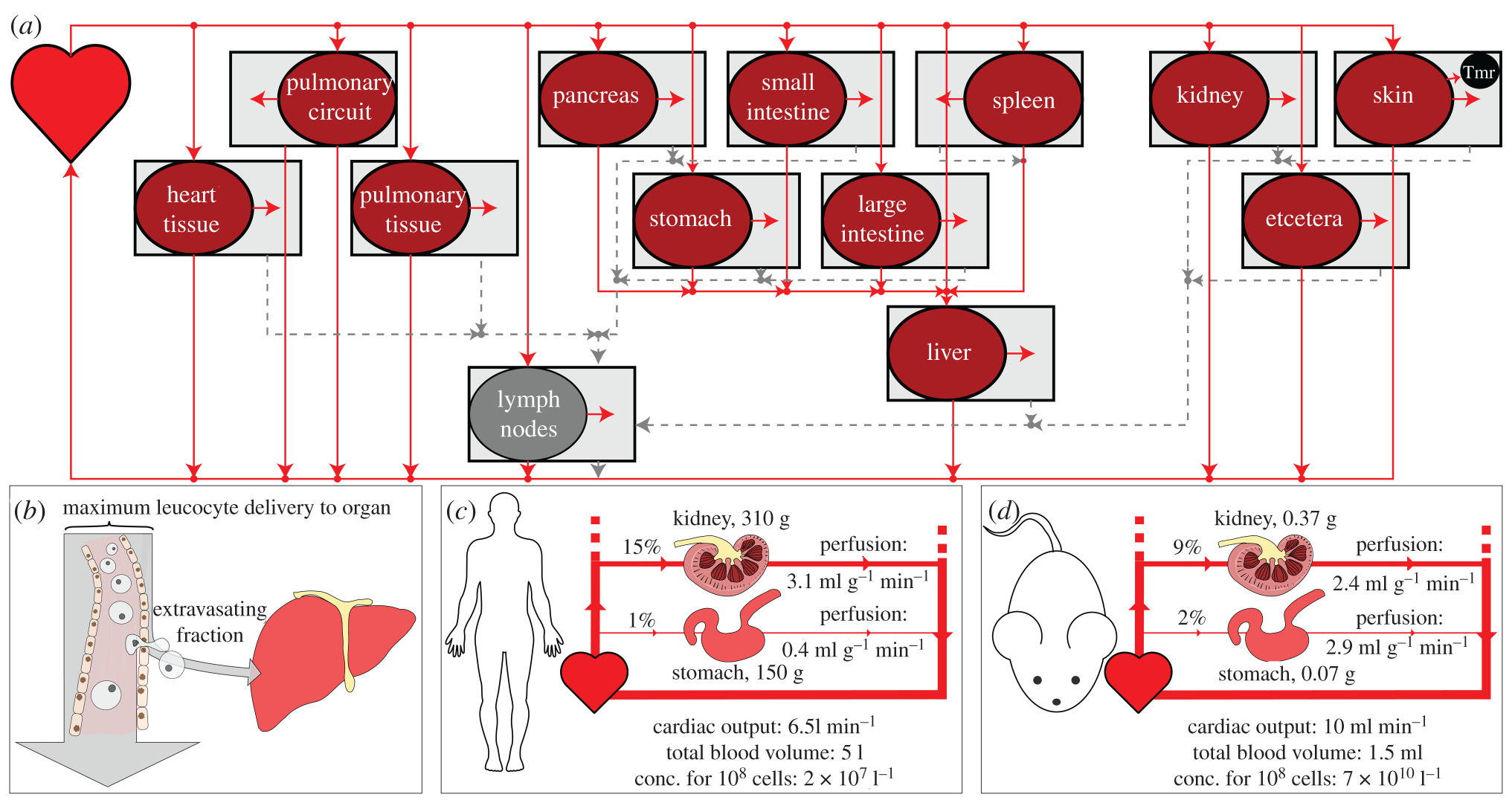
大多数基于生理学的药代动力学(PBPK)或细胞动力学(PBCK)的研究都使用代表解剖结构的常微分方程(ODE)模型。适用于此类方程的解剖示意图如图1a所示。假设T细胞从心脏流向不同器官的脉管系统,然后它们返回或外渗到该器官的间质空间。外渗的细胞通过淋巴管返回循环,但脾脏和肺回路除外,细胞直接从脾脏和肺回路返回。为了计算最大递送速率,我们需要脉管系统递送细胞的速率,如图1b所示。
这等于器官灌注(血流量B占总器官体积V)乘以血药浓度C。更准确地说
器官的最大输送速率 $o=\frac{B_o}{\tilde{V}o} \frac{N{\text {tot }}}{V_h+\sum_o V_o}$ 公式 2.1
Ntot是总细胞数, Vo and V~o 分别是器官o和V的血管和总 Vh为心脏和相互连接的血管中的体积.
为了比较不同器官中的肿瘤和健康组织,我们将一个器官定义为携带肿瘤的器官,其中包含1立方毫米的肿瘤 (TMR) 组织体积。我们将这个体积视为健康组织或肿瘤组织,以找出每个器官和物种的预测递送率有何不同。
### 文献参数选择
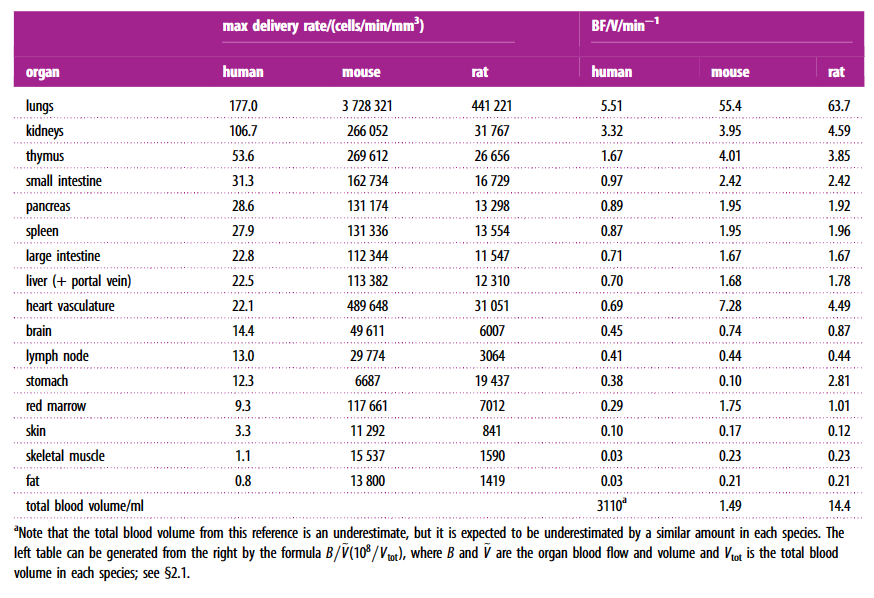
预测的T细胞递送率取决于假设的解剖参数(血流,血容量和器官体积)。我们从文献中收集了几个解剖学参考库,特别是ICRP和Shah及其同事的汇编。每个来源的血流量和血量略有不同。为了消除选择偏倚,使用解剖参数的许多随机值(n = 100每个器官每个物种)计算递交率,从文献值范围内均匀选择,然后采取估计递交率的平均值和标准差。
这也代表了种群变异性。为了避免对单个模型动物使用来自不同研究的数据,选择了尽可能完整的数据集。特别是,从每个参考文献记录总血流量和血容量,每个器官的体积以及每个器官的血流量和血容量。
呈现的结果是通过从文献中选择随机值获得的预测的平均值和标准偏差。随机参数值是从文献值范围内选择的。
此过程重复100次以产生呈现的结果。当考虑肿瘤灌注与健康器官灌注不同时,我们使用文献中的肿瘤灌注测量值,并假设由于这些都是不同肿瘤的测量值,因此数据应服从正态分布。因此,我们选择肿瘤灌注的正态分布随机值。
### 结果呈现
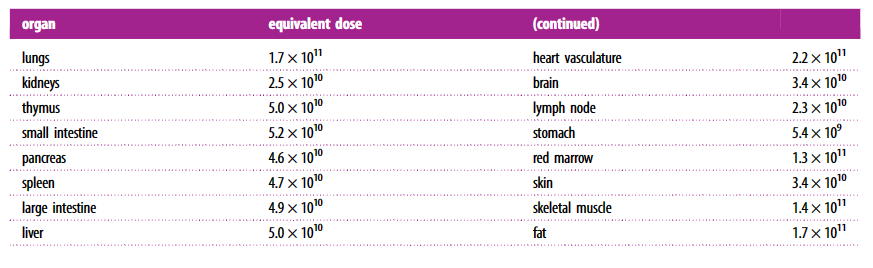
表1的结果是通过将Shah等人报告的数据应用于方程(2.1)获得。这在图1c,d中以图形方式表示。表2的结果是通过将小鼠与人类递送率的比率乘以给予小鼠的剂量而获得的.
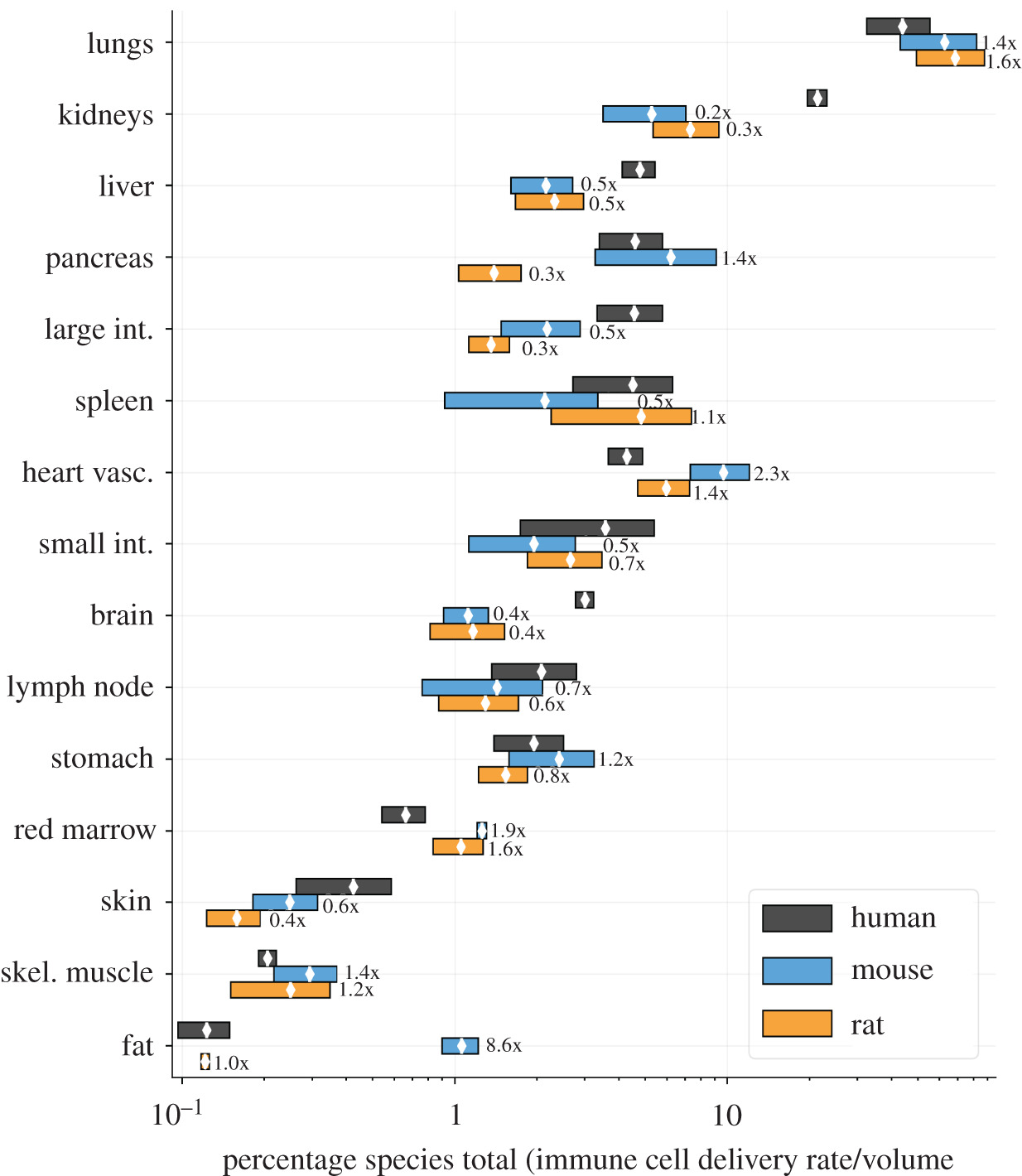
图2中的随机结果是通过绘制器官参数的均匀随机值(n = 100),用公式(2.1)计算每组值的每体积最大递送率,然后找到它们的平均值和标准偏差获得的。为每个器官选择n = 100个值以生成交付率变异性的指示,同时确保所选随机参数的平均值在实验参数值实际平均值的5
结果
将CAR-T细胞递送到人类、小鼠和大鼠的器官
我们计算并比较了每体积血管输送率(细胞/分钟/立方毫米)临床上使用的典型数量的CAR-T细胞到不同人,大鼠和小鼠器官中的非肿瘤组织。这些速率等于器官灌注和CAR-T细胞血液浓度的乘积,如图1b-d所示。从单个解剖数据集计算的结果如表1所示。来自肝动脉和门静脉的流量都包括在向肝脏的输送率中,肺循环和肺血供应都包括在肺率中。不同物种对同一器官的递送率差异可能是极端的,如果对每个物种施用相同数量的CAR-T细胞,则预测小鼠每体积的绝对肺递送率比人类高21000倍(通过除以表3中的700 000 180/1获得)。如果考虑已知的内源性细胞血液浓度而不是恒定数字,那么每体积的速率仅取决于器官灌注,并且小鼠的绝对输送率比人类高10倍。这些数据表明,将小鼠剂量扩展到人类(反之亦然)的更合适的方法是确保达到与目标组织的相同细胞递送率。
表1的结果用于计算在人体CAR-T细胞的剂量(引入的细胞数),获得与典型临床前的小鼠相同的递送率所需的CAR-T细胞剂量(引入的细胞数)10^7 CAR-T 细胞。等效剂量是器官特异性的,大多数是10^10–10^11细胞(表2)。
通过从所有数据集中随机选择解剖参数获得的预测传递速率的平均值和标准偏差如图2所示。为了说明器官特异性缩放并允许跨器官传递速率分布的种间比较,按物种缩放速率,使得每个物种内的平均预测总和为100。分布具有相似性,但其他方面相对速率表现出器官特异性缩放。对于每个物种,肺的输送率最高,其次是肾脏。
CAR T 细胞递送到人类肿瘤
预测组织最大输送速率假设灌注在给定器官内是均匀的。然而,肿瘤的灌注可能与正常组织不同。对文献进行了调查,以量化人类肿瘤灌注的变异性,以纳入最大分娩率的估计。和以前一样,输送率是用许多随机参数值(每个器官 n=100),均匀绘制所有器官参数和肿瘤灌注的高斯分布。显示了CAR-T细胞对人类肿瘤的预测递送速率的平均值和标准差,以及假设均匀灌注下的相应递送率。肿瘤和正常组织的输送率的排名顺序非常不同。在大多数情况下,肿瘤组织的预测递送率平均值与正常组织的预测递送率相似或小于正常组织,但在某些情况下(例如皮肤)它要大得多。然而,它们的变化是相当大的;对于大多数器官,极值在高于和低于相应正常组织的极值上变化许多数量级。
细胞递率估计值与 PET 成像和射线照相数据一致
可以通过比较人类和啮齿动物的PET成像和射线照相研究的数据来测试器官“最大递送率”的有效性,其中记录了早期时间点的细胞定位。使用早期时间点至关重要,因为它显示了仍在血液中或最近外渗到器官中的细胞的位置,然后它们排回血液并再循环。在后来的时间点,定位是细胞输送到器官、返回循环和其他调节这些因素的因素(如抗原识别)的功能。
- 讨论
4.1. 血管输送和细胞增殖
本研究旨在量化血液向不同物种靶组织递送CAR-T细胞速率的生理限制,以便从临床前数据中更好地预测适当的临床CAR-T细胞剂量。它专注于过继性T细胞癌疗法,尽管该方法也可能适用于其他治疗领域,包括免疫相关的不良事件预测。计算时假设 10^8引入T细胞;由于任何其他所需细胞数或血药浓度的递送率可以通过将结果乘以所需数与 10 的比率来计算8或将血液浓度乘以目标物种的总血容量。虽然过去已经研究了预测T细胞群扩增的模型[9,44],但很难量化给定组织中的细胞增殖或部分再循环。然而,增殖本身取决于转移的T细胞暴露于其靶抗原,因此早期反应预计将受到递送的限制。一些研究已经确定了细胞治疗的剂量或有效早期靶点参与与反应之间的关系,尽管增殖随着时间的推移增加了有效剂量[17,43,45,46]。此外,在给定肿瘤部位外增殖的细胞的递送也将受到血管递送的限制。与考虑增殖和收缩的T细胞浓度的估计时间过程相比,可以以更大的置信度和更广泛的适用性估计解剖结构引起的最大递送速率,因此在这项工作中没有考虑增殖,并且将成为未来研究的重点。
4.2. 器官特异性递送率及其变化
结果预测,CAR-T细胞递送率最高的是灌注最高的器官:人类的肺和肾脏(图2)。当考虑肿瘤特异性灌注的测量时(图 3),肾脏、皮肤、大肠和肺的每毫米输送率预计最高3,与对肾脏、皮肤、结肠和肺部肿瘤疗效最高的非细胞免疫疗法(IL-2和检查点阻断)一致[47-52],以及疗效部分由组织灌注驱动的假设。对于包括CAR-T细胞在内的细胞疗法,血管递送应与疗效类似相关,而T细胞必须外渗到靶组织中的额外因素。幼稚和离体T细胞均优先外渗至淋巴结、脾脏和肝脏[53-55],与CAR-T细胞对血液系统疾病的疗效一致,但与实体瘤无效[1,42,43]。肿瘤组织可以是血管性的或非血管性的,发炎或未发炎,这意味着正常组织的预测“最大”递送率可能不适用于肿瘤。然而,预测的肿瘤平均递送率仅超过少数器官(图 3),包括皮肤。预测的皮肤肿瘤递送率在许多数量级上有所不同,但通常大于正常组织的递送率。健康的皮肤通常不会高度灌注,并且包含分流器以控制血液流动以响应温度。大多数皮肤解剖学数据描述了器官在休息和室温下没有炎症,这意味着大多数分流器将是开放的。肿瘤组织可以通过炎症或血管生成增加其灌注,并可能破坏这些分流,这可以解释皮肤肿瘤预测递送率的更大平均值和变化。肝脏和肾脏组织在休息时高度灌注,随机肿瘤血管生成不太可能改善;因此,这些器官中肿瘤的预测递送率不超过正常组织。对红骨髓的预测表明,肿瘤灌注可以大大超过正常组织灌注。虽然令人惊讶,但骨红骨髓结果与在骨癌和转移患者的健康对照骨和肿瘤部位测量骨灌注的研究一致[56]。骨髓的预测率特别有趣,因为许多血液系统恶性肿瘤部分存在于该组织内;图3所示的肿瘤灌注增加可以解释为什么表1中预测的相对较低的递送率与CAR-T细胞对抗血液系统恶性肿瘤的相对成功并不矛盾。
最后,预测的肺肿瘤递送率可能会也可能不会超过正常组织的递送率,这取决于肺回路是否被认为有助于肿瘤血液供应(蓝色虚线框)或不(绿色虚线框)。除了这些例外之外,结果表明,在大多数情况下,预测到正常组织的最大递送率大于对同源肿瘤组织的预测最大递送率,因此适合用作比较物种的指南。
图2和图3都表明,预测的交付率变化很大,这可能是由实验技术的差异或个体差异引起的。生理差异和行为都会影响血流分布;餐后流向肠系膜的血液、运动期间的肌肉或皮肤对温度的反应增加。这种效果在临床上用于通过冷却头皮来防止化疗患者的脱发。CAR T细胞疗法可以通过膳食消耗或温度控制靶向肠系膜或皮肤等器官,并且可以通过与抗血管生成治疗(例如阿瓦斯汀)相关的血管正常化来增加肿瘤特异性血流量。在晚期转移性疾病患者中,CAR T细胞剂量必须足以在最少灌注和/或生长最快的部位驱动肿瘤消退。为避免细胞因子释放或脑病综合征等不良事件与剂量相关的增加,应考虑在现场而非其他地方增加有效剂量的方法,包括替代给药方式、在目标部位触发增殖、共同给药抑制剂(例如抗 IL6)或改变血流的干预措施。人类和啮齿动物的解剖参数各不相同,会影响任何依赖于解剖参数的结果。如果未捕获变异性和/或未注意控制改变血流的因素(例如麻醉、运动或一天中的时间[57]),则数据集的比较可能无效。理想情况下,任何使用血流和器官体积的研究都应该考虑多次测量,并包括“误差”条以指示变化。
4.3. 物种特异性递送率和剂量比例
每个物种的相对递送率在器官间分布不同,这意味着剂量缩放具有器官特异性(图 2和表 1)。相同剂量CAR-T细胞的预测绝对递送率(108)在物种之间表现出令人惊讶的极端差异,每单位组织体积向小鼠肺部的输送量比人类高21 000倍,主要是因为小鼠(2毫升)和人类(5升)之间的总血容量不同。为了测试这些“最大递送率”的相关性并验证模型,我们分析了已发表的人类和大鼠自然杀伤(NK)细胞的PET成像和射线照相研究[39-41],并计算了早期时间点存在于各个器官中的细胞数量(§3.3)。将输注后30 min肺、肝、脾中NK单位体积的人/大鼠比值与预测最大递送率的人/大鼠比值进行比较。测得的定位比率比交付率比率的预测高1.3-2.0倍。这种小的差异并不出乎意料,因为如果NK细胞的血液浓度和递送率恒定,递送率比率只会等于定位率。然而,最早的实验时间点是30分钟,为血液再循环提供了足够的时间(因为人类和大鼠的心输出量/分钟大于总血容量)。人类和大鼠在每个器官中的外渗和返回率可能不同,并且两个研究在第一个时间点的实验技术和放射性总量不同。无论这些潜在的混杂因素如何,观测结果都与预测一致。该验证是使用NK细胞而不是T细胞进行的,T细胞可能具有不同的归巢受体或运输。然而,我们比较了最大递送率,这仅取决于解剖因素,而不是细胞特异性因素,因此具有相同血浓度的NK和T细胞的最大递送率是相同的。同样,这种验证是使用大鼠而不是小鼠进行的,尽管小鼠 - 人类比较是这项工作的更多重点。比较是通过解剖学参数进行的,这些参数对小鼠和大鼠都有很好的表征。鉴于人类和大鼠中测量的细胞定位比例与其心血管系统的差异一致,没有理由相信人类和小鼠之间不会发生这种情况,特别是因为大鼠在身体上与小鼠相似。
为了进一步确认细胞定位部分取决于局部组织灌注,我们重新绘制了Ottaway&Parrott [21]的图5,他表明24小时后耳朵和各种淋巴结中淋巴细胞的定位与区域血流相关。由于许多淋巴细胞从淋巴管而不是直接从血液中到达淋巴结,人们可能认为这种组织类型的相关性最差,但对于大多数Ottaway和Parrott的分析,定位和区域血流之间存在显着相关性。局部血流量的增加是由于局部炎症,因此局部炎症可能与局部血流和淋巴细胞定位相关,即血流与淋巴细胞定位之间没有因果关系。然而,无论使用何种抗原,这种增加的定位都被证明会发生,因此增加的定位不太可能是由于外渗细胞比例的增加,支持淋巴细胞的递送部分取决于它们通过脉管系统的递送的假设。
尽管小鼠体内细胞的递送率远高于人类,但引入小鼠的典型剂量(细胞数)并不明显低于给予人类的剂量(细胞数)。大多数患者给予 CAR T 细胞剂量在 10 之间7和 109细胞[42,43],而小鼠研究使用了(例如)两种剂量的1–2.5×106 细胞
间隔一周[6],两剂10剂7细胞间隔一周[3],单剂量107细胞 [4]。为了说明这些剂量有多大,我们计算了等效的人类剂量,这些剂量在人类中产生与给定107CAR-T细胞(表 2)。所得剂量范围在1010和 1011T细胞,远高于典型临床剂量和许多剂量递增研究[43]。这也许可以解释为什么临床前的成功并不总是转化为临床。癌胚抗原(CEA)CAR-T细胞疗法的临床前研究导致小鼠皮下肿瘤消退,剂量为5×106单元格(相当于 1.7 × 1010在人类中)[58]。在另一项研究中,CAR T细胞疗法将所有治疗小鼠胰腺肿瘤的生长限制在检测限以下,剂量107 细胞
(相当于 4.6 × 1010在人类中)[59]。一项研究,其中较低剂量约为 105抗CD19细胞(人类当量,仅使用总血容量,2×108 细胞
)给予小鼠,因为“应激试验”与肿瘤控制不良有关[17]。在临床上,一项针对CEA CAR T细胞对抗结直肠癌的研究[46]将剂量递增至107和 1010细胞。作者发现,较低剂量并不能阻止肿瘤进展(在3名患者中有14名),而较高剂量只能实现稳定的疾病。我们的结果表明,剂量为10阶10需要细胞来驱动原发部位的肿瘤消退,并且 1011肺转移需要。临床研究中,肿瘤浸润淋巴细胞(TIL)被大量引入(109–1011) [60-63]并且CAR-T细胞被区域引入(绕过通过血流运输)[42]与更高的疗效相关。这里所做的简单比较的一个重要警告是,一些研究在输注有助于增殖的T细胞之前耗尽了小鼠或患者的淋巴细胞,而有些则没有。研究设计的其他差异也可能影响剂量的选择。在与匹配的作者或中心的临床前和临床工作中报告的相对人和小鼠剂量也与上面讨论的相似:106在小鼠和107–1010人类抗CEA CAR-T细胞[46,64],105–106小鼠细胞和109人类细胞用于抗间皮素CAR-T细胞的研究[65,66]和106小鼠细胞和109–1011Rosenberg及其同事对人类细胞进行TIL研究[62,63,67]。
我们使用自然杀伤细胞定位数据来验证模型,确认细胞的早期定位与预测的最大递送速率相关,并假设自然杀伤细胞和T细胞在短时间内表现相似。更合适的验证是将预测与小鼠和人类中过继转移细胞定位到实体瘤进行比较,然而,这些数据很少发表,我们没有发现人类报告的数据,包括早期时间点的器官和肿瘤定位(大约几分钟)。这些数据将有助于进一步的工作,可用于量化细胞归巢和增殖所施加的后续限制的时间过程也很有用。
这里提供的数字比较了小鼠和人类之间的器官,但许多小鼠研究使用皮下肿瘤,并且异种移植物的灌注规模比普通组织更不确定。假设免疫细胞的血浓度相同,小鼠和人类之间每体积对皮肤组织的最大递送速率之比为2,如果假设免疫细胞数量相同,则为3400(从表1计算)。例如,如果使用相同浓度的细胞,则每体积对小鼠皮肤与人肾组织的递送速率之比为0.05,如果假设相同数量的免疫细胞,则为100。先前的一项研究[68]表明,小异种移植物与原始组织具有相似的局部灌注,但较大的异种移植物相对于原始组织的灌注减少。这种非线性进一步混淆了临床前结果的外推,并突出了临床前小鼠异种移植模型结果临床转化中观察到的一些困难[69]。然而,预测的小鼠皮肤最大递送率仍然比任何人体组织的预测速率高出几个数量级,这表明皮下小鼠模型仍将比人类研究显示出更大的疗效。此外,原位肿瘤移植物的小鼠研究报告了与皮下肿瘤相似剂量的成功:原位、物种匹配的胰腺肿瘤被根除 107CAR T细胞[59],原位胶质母细胞瘤异种移植物明显减慢(但未根除)2×106CAR-T细胞[70],脑桥胶质瘤异种移植物引入小鼠脑桥,脊髓或丘脑107CAR-T细胞[71]和原位肝细胞癌异种移植物在小鼠中消除或大幅减少5-20×105CAR-T细胞[72]。这些考虑表明,对临床前治疗成功的解释除了考虑生理和免疫学差异(例如T细胞外渗所需的粘附分子)外,还需要将剂量适当地扩展到人类。考虑跨物种器官特异性血流量和体积的模型可用于比异速生长缩放更精确地估计可能有效的人体剂量。
4.4. 通过 T 细胞归巢进行预测细化和进一步考虑
呈现的结果是每单位体积CAR-T细胞的预测最大递送速率(细胞/分钟/毫米3)到器官和肿瘤,仅基于器官血流量和体积。完善这些预测需要量化CAR-T细胞增殖和器官特异性归巢。T细胞外渗的概率因位置和细胞类型而异。幼稚T细胞主要外渗到淋巴结或脾脏,活化细胞外渗到非淋巴组织的可能性更高[53,73],根据上调的归巢受体(例如L-选择素或CCR7)分布[74])。这些概率可能因物种而异(例如,归巢受体CXCR1存在于人类中,但不存在[75]),进一步限制了临床前结果的种间外推。肿瘤组织中的归巢受体密度、血管正常化和归巢概率可能进一步不同,尤其是在阿瓦斯汀等治疗后[76,77]。通过将常微分方程模型(如电子补充材料§A.1中显示的模型)拟合到实验动物的T细胞定位数据中,可以量化器官特异性归巢,就像以前的作者所做的那样,例如[31]。这种归巢概率的量化将允许将T细胞运输模型应用于病例报告,其中测量了转基因细胞的最终定位(例如[78]),用于诊断目的。然而,我们发现有限的人类数据具有多个跨物种比较的早期时间点,这是这项工作的主要目的。由于动物和细胞的差异,从拟合到多个实验中获得的参数会有所不同,因此需要几个数据集来量化参数估计的变化和/或置信区间。此外,这项研究的重点是抗肿瘤疗法,其中肿瘤归巢将进一步受到炎症等因素的影响。出于这个原因,我们选择通过检查T细胞在靶器官中具有100
实体瘤中CAR-T细胞的另一个挑战是鉴定合适的靶抗原。理想的抗原在肿瘤细胞上高度表达,而不是在其他地方的健康细胞上表达。B细胞恶性肿瘤的典型靶标是CD19[43],因为它由整个B细胞池表达,并且几乎仅限于B细胞。几种不同的抗原已被靶向实体瘤,但收效有限(例如,GD2取得了令人鼓舞的结果[43])。靶抗原可能仅由肿瘤细胞的一个子集表达,在身体其他部位可能并不罕见。例如,CAIX在一些肾细胞癌中表达,但在一项III.期试验中,CAIX也在肝胆管中表达,导致靶向、非肿瘤毒性[79]。肿瘤可能会演变为减少靶抗原的表达,以响应成功的T细胞杀伤,降低肿瘤消除率或促进治疗耐药细胞的生长。尽管这些考虑因素是治疗成功的障碍,但细胞递送的速度是一个平行且重要的因素。考虑到T细胞递送和增殖的综合速率,如果对大多数肿瘤细胞上表达的抗原具有特异性的CAR-T细胞的杀伤率低于肿瘤生长速率,则不会驱动肿瘤消退。另一方面,针对稀有抗原的特异性CAR-T细胞可能会驱动肿瘤消退,如果它们到达足够数量以消除所有携带该抗原的细胞,随后增殖到更大的数量以驱动更受限制的位点的消退和/或驱动对一种或多种其他抗原的二次反应(即表位扩散)。与T细胞递送率和T细胞外渗概率一样,典型的肿瘤生长速率是物种,器官和个体特异性的。总之,这些考虑表明肿瘤免疫治疗是一个数字游戏,因此更普遍的定量研究可以成为了解临床前和临床结果之间转化差距的有用工具。
- 结论
考虑人,大鼠和小鼠循环系统的细节,以预测CAR-T细胞向人类肿瘤以及人,大鼠和小鼠器官的递送。预测显示,小鼠每单位体积靶组织的CAR T细胞递送量比人类增加10 000倍,而典型的临床细胞治疗剂量比典型的临床前剂量少100倍。这些数字与NK细胞定位的实验研究和各种临床观察一致。这些预测可以部分解释为什么CAR-T细胞清除实体瘤的临床前模型显示出比人类更高的疗效。发现剂量缩放是器官特异性的,对于异种移植物尤其难以量化,混淆了临床前结果的解释并降低了其潜在的临床价值,这是减少和替代动物实验背景下的重要考虑因素。通过运动、昼夜节律时间或食物消耗来控制肿瘤和器官特异性血流可以增加细胞向肿瘤部位的输送,而不会增加不良后果的可能性,而血管正常化也可能引起这种益处,尽管伴随着风险。更一般地说,细胞动力学和动力学模型将更好地理解临床前结果如何转化为临床,从而更好地确定基于细胞的疗法的适当临床剂量和治疗策略。
文章评论