CAR-T疗法原理及其研究进展
CAR-T疗法简介
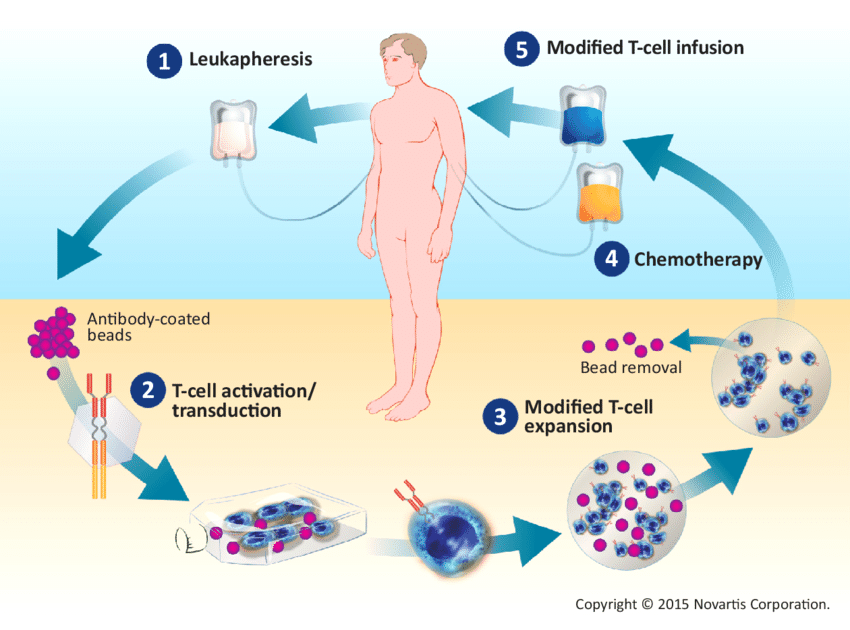
CAR-T治疗又称嵌合抗原受体T细胞治疗,是将人的T细胞经过基因工程手段体外修饰改造后,回输患者体内,用于治疗疾病。CAR-T技术逐渐发展,临床结果表明CAR-T细胞在治疗血液系统恶性肿瘤具有极大的优势。但随着研究的深入和应用的不断增多,CAR-T治疗产生的不良反应逐渐被认识和关注。2021年3月发表于《Nature》杂志上的一篇文章《Recent advances and discoveries in the mechanisms and functions of CAR T cells》,主要介绍了近3年CAR-T治疗过程中有效性和安全性问题
CAR-T细胞治疗
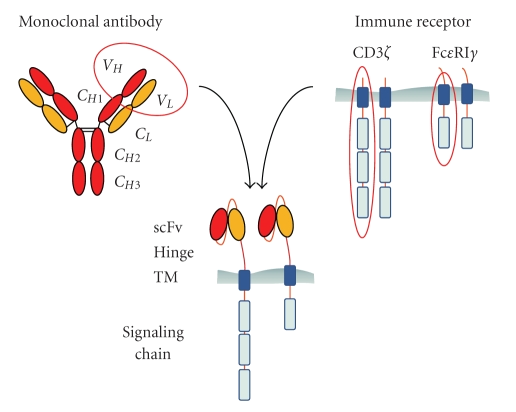
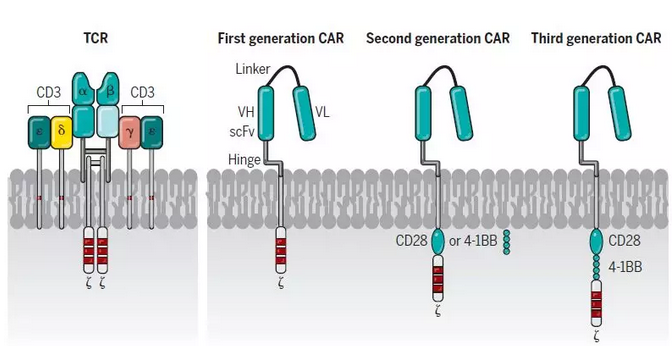
嵌合抗原受体T细胞是抗体的单链可变区域(scFv)与T细胞表面受体嵌合于T细胞上,主要由三部分组成即胞外区、跨膜区和胞内区域。胞外区常为单链抗体(scFv),负责识别并结合靶抗原;跨膜区是铰链或间隔区,可将scFv锚定于细胞膜上;胞内信号域由共刺激因子和CD3信号域组成。当抗原被识别和结合后,产生刺激信号传至胞内信号域,T细胞被激活并发挥效应功能。
第一代CARs由胞外抗原识别区即单链可变片段(scFv)组成,融合跨膜区和T细胞受体(TCR)CD3ζ分子胞内信号域。然而,由于一代CAR-T细胞扩增慢和持久性差,在临床试验中疗效甚微。
第二代CARs包含一个共刺激域,其衍生自CD28或4-1BB结构域,位于跨膜区和CD3信号传导域之间。研究结果表明,靶向CD19二代CAR-T细胞在临床治疗中效果显著。2017年美国FDA批准首款靶向CD19二代CAR-T产品上市)。
第三代CARs在第二代CAR基础上增加了一个共刺激域,增强T细胞信号转导,后续发展了多代CAR分子,在此不再赘述。目前,FDA已批准了共4款CAR-T药物上市。可见,CAR-T治疗为肿瘤治疗打开了新的大门。
CAR-T细胞治疗的毒副作用
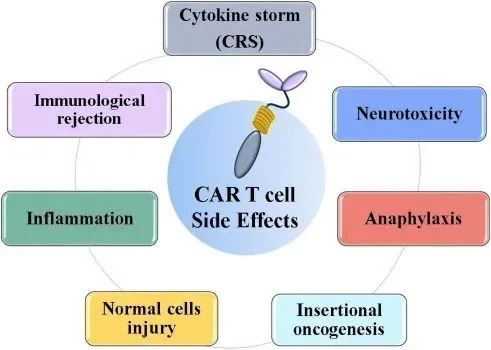
在CAR-T治疗过程中,临床上常见的是细胞因子风暴(CRS)和神经毒性(Neurotoxicity)。CRS患者通常在CAR-T细胞治疗的第一周内表现为发热、低血压和呼吸功能不全,并伴有高细胞因子水平;神经毒性表现为暂时性工作记忆丧失、神志不清、癫痫发作等。
毒副作用解决措施:
1.干预细胞因子,抗体阻断IL-1、IL-6和GM-CSF,阻断过度炎症反应。
2.控制T细胞的过度激活,采用酪氨酸激酶抑制剂,阻断激活信号传导。
3.化学药物阻断细胞因子的过度释放,采用甲胺酸阻断儿茶酚胺样作用。
CAR-T治疗的耐性与抗性问题
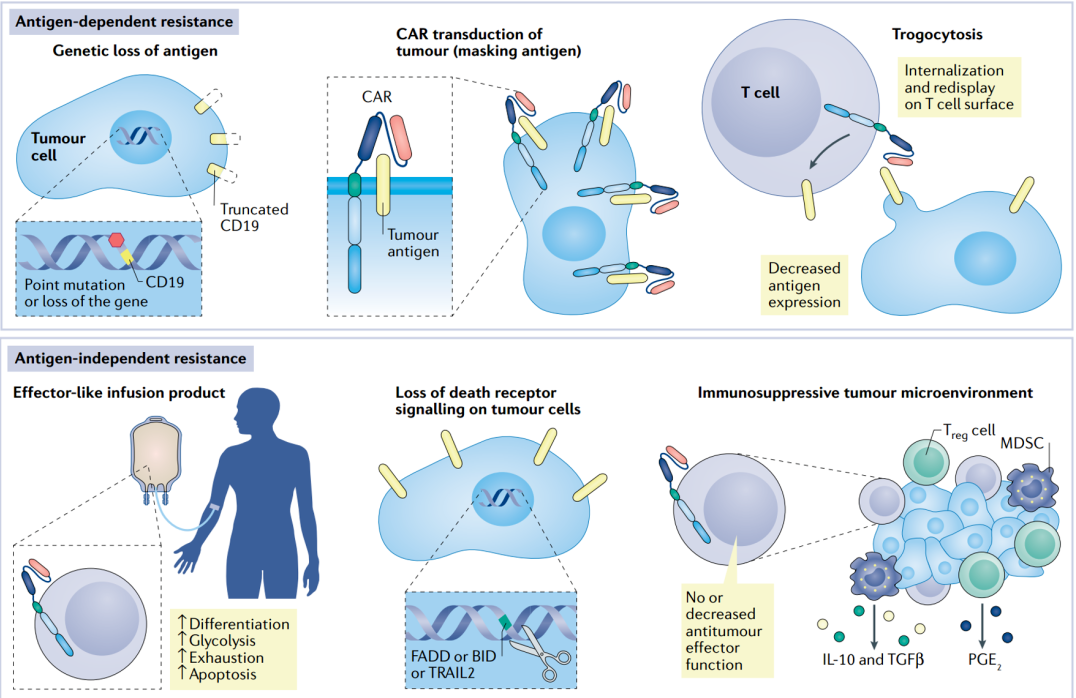
除毒性反应外,CAR-T治疗过程中也会产生抗性的问题,根据机制的不同可分为抗原依赖性和非抗原依赖性两方面。
1.抗原依赖性
导致原因:
1.靶抗原丢失( 指CAR分子能够从肿瘤细胞上移除目标抗原,并将其内化,降低肿瘤细胞上的抗原密度)。
2.靶抗原的基因突变导致靶标不能被有效识别。
3.靶抗原表位被遮蔽。
解决措施:
1.设计多靶向的CAR分子;
2.增加靶抗原的表达;
3.提高scFv与靶抗原的亲和力,可能有助于CAR-T细胞识别低密度的靶抗原。
2.非抗原依赖性
导致原因:
1.T细胞表面死亡受体缺失,造成T细胞过度耗竭。
2.肿瘤细胞表面配体分子缺失,如FAS相关死亡蛋白(FADD)、肿瘤坏死因子相关凋亡诱导配体-2(TRAIL-2)的缺失使肿瘤细胞在体外和体内对CAR T细胞更具抵抗作用。
解决措施:
(1)阻断免疫抑制检查点,阻止T细胞耗竭,可修饰CAR-T细胞上的PD-1分子,在细胞表面表达PD-1的显性负性受体或采用CRISPR-Cas9基因编辑技术敲除T细胞上PD-1的基因。
(2)提高CAR-T细胞的增殖能力、持久性和抗瘤活性,可在CAR-T细胞上表达IL-7受体。
(3)改变T细胞终末状态的分化,研究表明过表达c-Jun AP1转录因子可以降低T细胞耗竭(参考文献7)。
3.肿瘤免疫抑制微环境(TME)
肿瘤免疫抑制微环境包括免疫抑制细胞(如Treg细胞、髓系抑制细胞)和抑制分子(如TGF-β、IL-6、IL-10和PGE-2)能够抑制CAR-T细胞。
解决措施:
(1)增强CAR-T细胞的浸润能力,可过表达IL-7和CCL-19。
(2)改变Treg介导免疫抑制作用。
研究进展
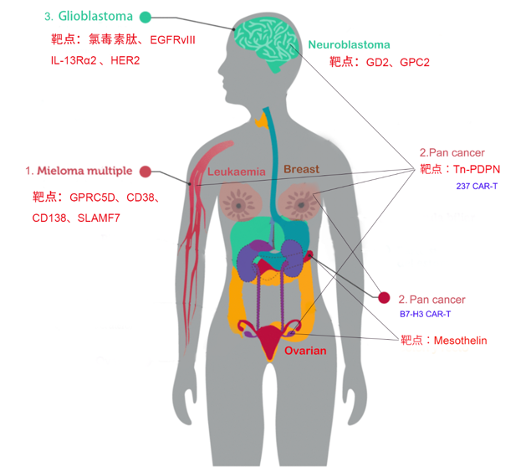
1.新靶点和新治疗CAR-T
多发骨髓瘤:新靶点GPRC5D(G蛋白偶联受体)、CD38、CD138、SLAMF7
泛癌:免疫检查点分子B7-H3(CD276)、Tn-PDPN等
脑瘤:氯毒素肽
此外,某些特定T细胞亚群修饰的CAR-T细胞可能会产生较好的效果。
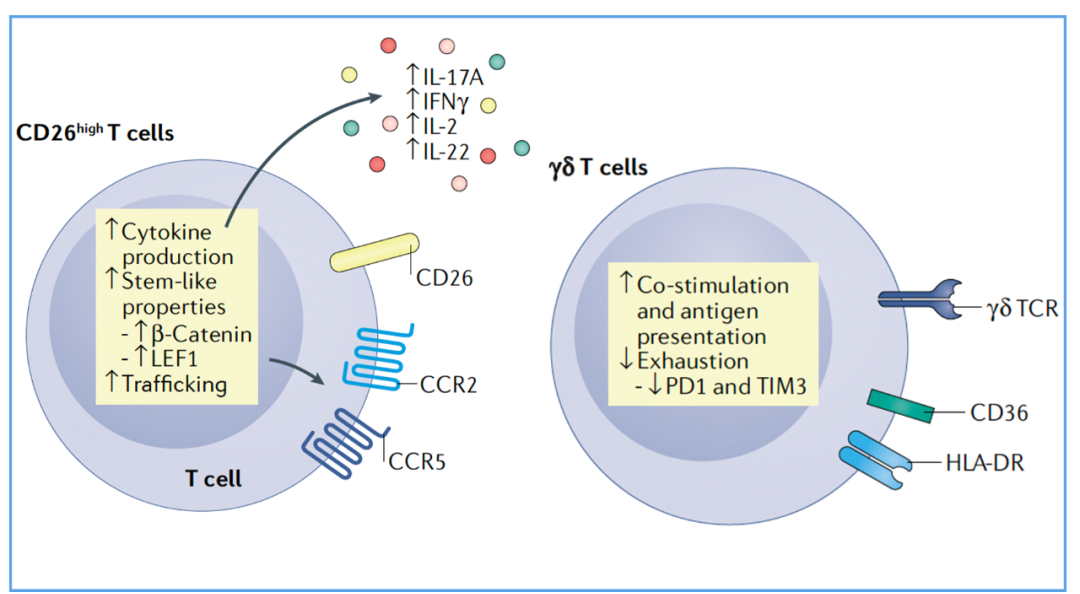
CD26highCAR-T细胞,能够产生IL-17A、IFN-γ、IL-2和IL-22,细胞表面表达CCR2和CCR5,具记忆干细胞样特性。
γδT细胞来源的CAR-T细胞,γδT细胞能耐受T细胞耗竭,其表面抑制性受体(TIM3和PD-1)表达水平较低,能够交叉递呈肿瘤抗原。
2.通用型细胞治疗
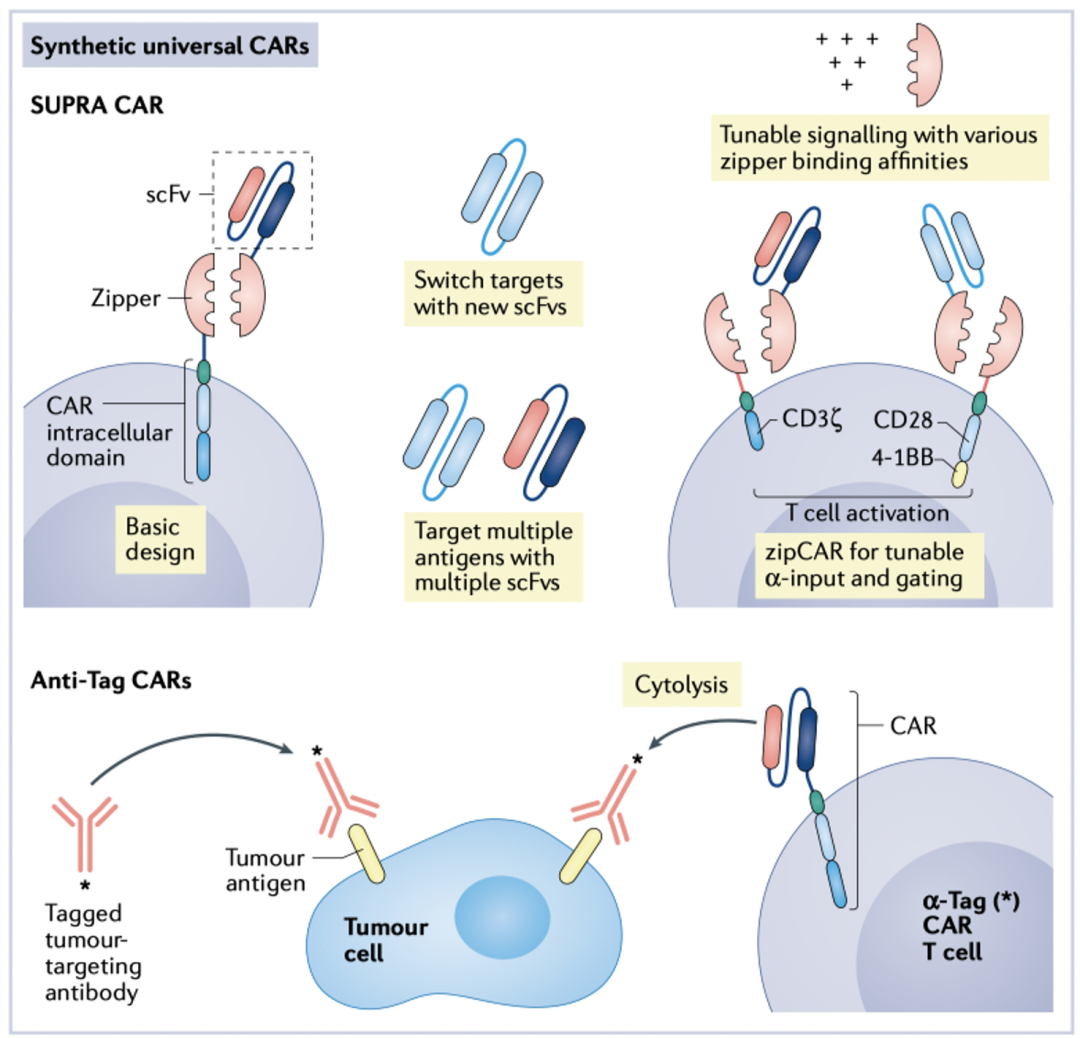
通用型细胞治疗是未来发展的方向,其主要难点是GvHD宿主抗移植物反应。宿主抗移植物反应与TCR上的HLA基因相关。通用CAR细胞治疗,一种思路是编辑修饰相关基因,如TALEN基因编辑的TCR-α基因或者CRISPR-Cas9基因编辑敲除TCR上的HLA基因;另一种思路是设计CAR分子,zipper-CAR系统通过zipper蛋白的受体和配体桥接scFv和CAR分子胞内结构,通过更换不同的scFv设计靶向多抗原的通用CAR。
3.CAR-X细胞
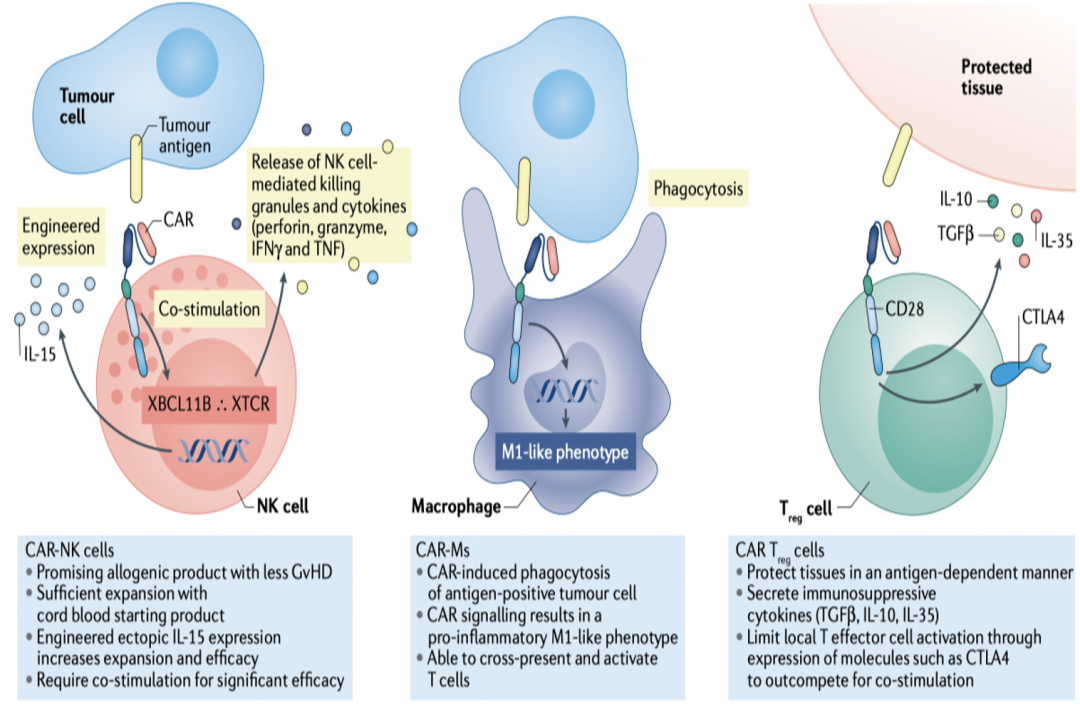
CAR-NK细胞:NK细胞是自然杀伤细胞,具有天然的抗肿瘤作用。其优点是无MHC限制性,安全性较高,可制备同种异体细胞,CAR-NK是通用型细胞治疗一个比较好的选择。
CAR-M巨噬细胞:巨噬细胞具有抗原特异性吞噬和促炎极化作用,能交叉递呈抗原并激活T细胞。研究表明CAR-M巨噬细胞在小鼠肺癌转移模型中展示了较强的抗肿瘤活性。
CAR-Treg细胞:Treg细胞能够分泌免疫抑制分子TGFβ, IL -10, IL-35,可用于治疗自身免疫性疾病和器官移植的排斥反应,也可防止T细胞过度激活。
小结
CAR-T细胞治疗已发展了三十余年,临床上也取得了较好的治疗效果。但风险与机遇并存,CAR-T细胞治疗中也表现出了潜在的毒性和耐药性问题,由此加速了寻找肿瘤新靶点、研究信号机制和开发新技术的步伐。在CAR分子设计、转导方法和选择最佳细胞类型方面的创新可能会带来新的突破,改变未来肿瘤的治疗方式
CAR-T疗法及其药物的PK,PD特征
CAR-T具有以下特点:
- 体内扩增;
2.高度个体化;
3.产量小、批次有限;
4.起始材料差异性大;
5.制备工艺不成熟;
6.生物学效力以及安全性评价复杂。
体外药效学研究
CAR-T的效力检测是通过肿瘤杀伤率或增殖抑制率来体现,也可以通过IFN-γ的表达量、CAR-T细胞表型变化来进行检测。对于CAR-T的方法学验证,要进行专属性和量效关系的验证,最好能够用体内法验证体外法的有效性。
通常,CAR-T细胞与阳性/高和阴性/低靶表达细胞类型的共培养可以深入了解CAR结构的药理学,其中对靶表达细胞的T细胞激活和细胞死亡的定量可以显示出治疗的几个关键属性,如特异性和有效性。首先,在选择细胞系进行培养实验之前,需要确认靶抗原的表达程度,通常是通过RNAseq、IHC或流式细胞术。其次,TAA通常不仅在靶肿瘤细胞如肿瘤器官中表达,而且在一些正常细胞中也有表达。CAR-T是否表现出足够的治疗窗口期可以通过CAR-T与肿瘤器官或正常器官共培养来评估。另一方面,所设计的CAR-T是否能有效区分两种抗原,其预期的TAA靶点可能是与正常对照具有相似结构的癌基因突变体/异构体。表达接近靶标同源物的工程化细胞系可以用来确定这种特异性和任何潜在的靶外效应。第三,CAR-T介导的杀伤力可以通过在共培养试验中包括多重效靶比和时间点来确定。这样会对特定CAR-T的可行性和潜在的剂量信息有更深入的了解。最后,针对不同癌症类型的不同模型进行共培养评估有助于确定临床适应证。
体内药效学研究
CAR-T药效学(PD)检测方法有生物发光成像、流式细胞术等,用以检测动物体内肿瘤细胞数量和细胞因子变化。对于PD评价,则需要从肿瘤体积、重量、动物存活期等多项参数综合体现CAR-T的药效。
PD实验设计首先要确定多个剂量水平,以体现CAR-T的量效关系。其二,要设置溶媒对照,同时还要设置T细胞对照组,建议使用来自不同捐赠者的细胞生产的CAR-T细胞,以评估疗效的稳定性。PD研究可以设置卫星组,进行药代动力学,例如分布、迁移、归巢以及存续和消亡的一些特性研究,同时可以进行细胞因子和其他一些毒性指标的监测
用于CAR-T治疗的动物模型的主要特点如下:
1)模型需要具有所设计的CAR能够识别的具有人类靶点的肿瘤;
2)模型不应排斥CAR-T细胞;
3)理想情况下,模型具有合适的宿主环境,包括人体免疫和TME,使CAR-T细胞能够穿透并与宿主细胞相互作用
4) 尽管人类肿瘤异种移植模型最常用于CAR-T研究。但有时小鼠肿瘤模型也可以作为研究工具来研究小鼠CAR-T的作用机制和概念验证。
下图总结了应用于CAR-T细胞评价的小鼠模型。
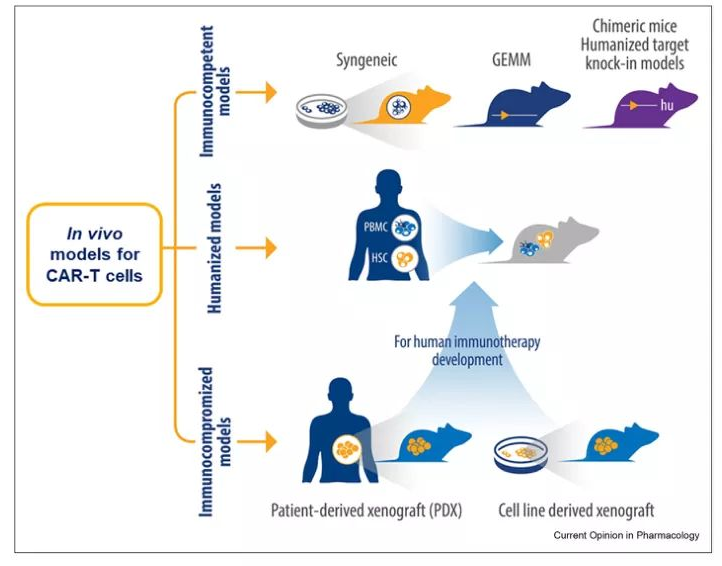
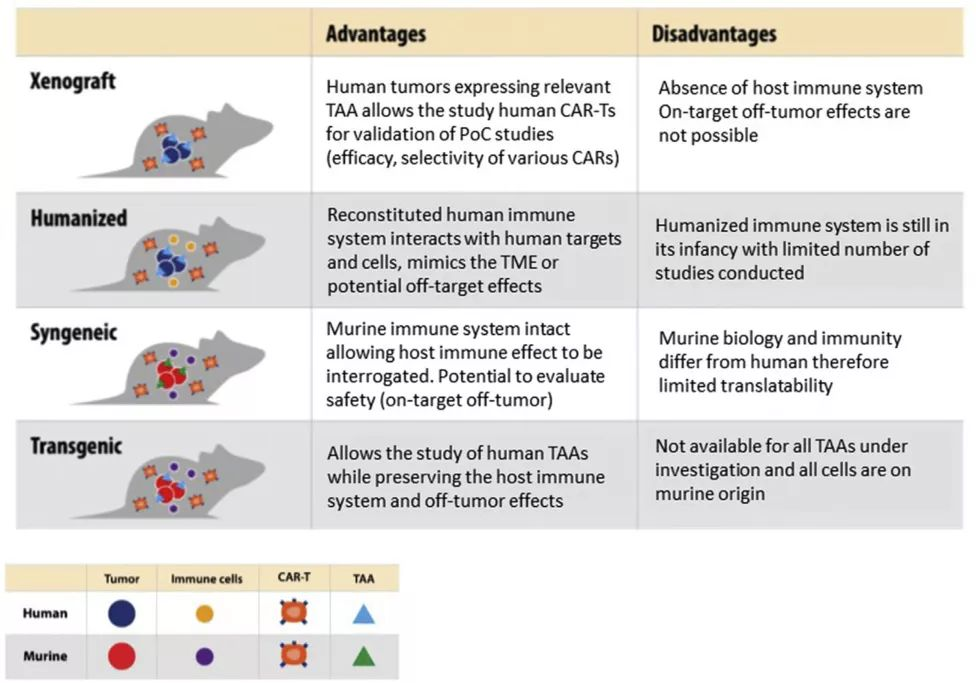
下图总结了异种移植、人源化、同基因和转基因小鼠模型的优缺点,以突出在选择模型时需要考虑的关键特征,这里不再详细介绍。根据研究目的仔细选择临床前模型可以更好地预测CAR-T疗法在人类患者中的有效性和毒性。
药代动力学研究
CAR-T药代动力学(PK)研究的目标是要弄清楚目标细胞在体内增殖、分布和存续时间。
研究模型可以使用免疫缺陷动物,也可以使用荷瘤动物,因为在肿瘤细胞存在的情况下,CAR-T细胞会大量增殖,并发挥生物学作用,这样将能够更好地体现CAR-T细胞在体内的PK。
PK的检测方法包括:1.使用成像技术直接观察;2.流式细胞术;3.免疫组化技术;4.使用定量PCR技术追踪CAR-T细胞在体内的分布以及存活情况。
安全性研究
对于非临床安全性评价,韦博士针对动物模型选择、研究目的和设计,以及免疫毒性、神经毒性、致瘤性评价方面进行了探讨,同时阐明了全面的安全性评价要点
文章评论