摘要
背景与目的: 清除率是缩放剂量、了解药物-药物相互作用风险和儿童环境风险评估的重要药代动力学概念。对儿童进行准确的清除率缩放需要事先了解成人清除率机制以及生理和酶发育的年龄依赖性。本研究的目的是开发和评估个体发育模型,以提供年龄依赖性的清除率评估。
方法:通过8个主要有一个过程消除通过化合物的儿童体外数据和/或体内清除率,建立基于发育的肾脏清除率、细胞色素 P450(CYP) 3A4、CYP2E1、CYP1A2、尿苷二磷酸葡萄糖醛基(UGT)2B7、UGT1A6、磺化和胆道清除率的个体发育模型。通过六种通过多种途径化合物对所得的个体发育模型进行了评估。描述了在成人每种清除途径的贡献和总清除的比例。每个途径都被单独缩放到所需的年龄,包括蛋白结合的预测,并汇总到儿童的总血浆清除率。本研究儿童年龄范围为早产儿至青少年。
结果:发育模型的实测清除率和预测清除率之间存在极好的相关性,模型相关系数为(R2 =0.979),测试集相关系数为(Q2 =0.927) 。 早产儿的清除率也可以很好的预测(发展 R2=951;检验Q2=0.899)。
结论:儿科临床试验的开展可以从清除率缩放中获益,特别是在指导给药方案方面。此外,由于通过不同消除途径的清除率比例与年龄有关,因此可以获得有关药物-药物相互用发展程度的 信息。
背景
儿童和婴幼儿在许多方面都是一个独特的患者群体。与成人相比,他们不同的生理和解剖属性会从药物的吸收,分布代谢和消除过程影响药物的药代动力学特征。因此,对儿童的药物管理需要根据年龄调整给药方案,以便在产生最佳治疗效果的同时将毒性不良反应的风险降到最低。市面上有大量药物的安全性、耐受性和有效性尚未在儿童身上得到证实。由于儿科医生对确保儿童获得适当治疗的道德承诺,在世界各地的临床实践中,儿童药物的超说明书使用(即以与制造商产品许可证中推荐的方式不同)和未经许可使用(即没有任何许可证或批准)相当普遍。两者都存在严重药物不良反应和毒性不良反应的重大风险。
因此,与成人相比,能够预测化合物在儿童体内药代动力学行为的潜在差异的替代方法是非常可取的。清除率是导致药代动力学特征的年龄依赖性的主要驱动因素之一。清除率取决于负责消除过程的个体器官的生理和酶状态。在儿童和年轻人中,清除器官的生理状态及其相关的酶活性与年龄有关。这项研究的目标是开发一种方法,通过有限的成人清除信息,理论上可在首次人体试验后获得,将清除率按比例缩放到任何年龄的儿童身上。为此,我们开发并评估了一种机制模型,该模型基于已知的清除过程和成人各自的清除值,结合儿童生理和酶促个体发育的改变,预测儿童清除的年龄依赖性。为了本研究的目的,研究了许多清除过程的年龄依赖性-即通过肾小球滤过和小管分泌的肾脏清除,通过I期(细胞色素P450[CYP]3A4,CYP2E1,CYP1A2)和II期(尿苷二磷酸葡萄糖醛基转移酶[UGT]2B7,UGT1A6,磺化)酶和胆道排泄的肝脏代谢过程的清除。
方法
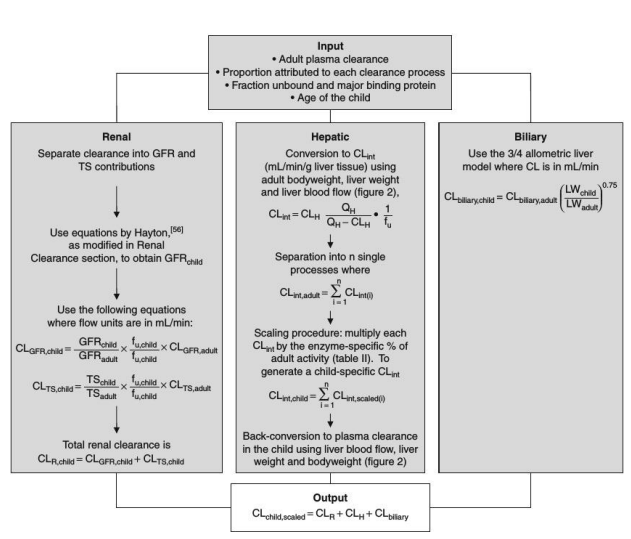
方法开发流程概述:图1描述了从成人到儿童的分级清除过程的概述。对于所研究的每种化合物都进行了研究,成人清除信息是清除过程的起点。根据所讨论的清除机制(肾、肝酶、胆道酶)的年龄特异性发展,根据儿童的年龄和生理状态(如肝脏重量、体重),将成人清除率按比例缩放到儿童。
信息准备和要求
首先,需要以下化合物特定信息:
- 成人清除率值
- 清除途径和每个途径对总清除率的相对贡献;
- 成人未结合的血浆部分(fu,adult)和主要结合血浆蛋白。
此外,还需要有关体重、肝脏重量、肝血流量(QH)随年龄变化的生理信息。
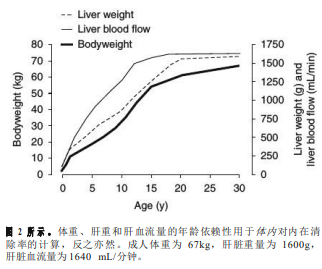
成人清除率信息是从使用健康成人的研究中收集的,如首次在人体实验研究。清除途径和每种途径对总清除率的相对贡献从文献中收集,并基于人体体内研究和肝酶途径测定的体外研究。根据国际放射防护委员会(ICRP)的出版物汇编了年龄相关的平均体重和肝脏重量。成人QH是门静脉前器官血流量的总和,包括肠、胃、胰腺和脾脏加上动脉肝血流量。门静脉血流约占QH的四分之三。根据ICRP中对成人的描述,通过保持每个器官的心输出量的相同百分比,将每个器官至门静脉前的血流按比例调整到儿童。儿童的心输出量是根据ICRP编制的。计算出的门静脉血流值与文献中发现的年龄相关值相当。肝动脉血流量每克肝脏重量的血流量与成人相同。为了在儿童中进行基于生理的药代动力学(PBPK)建模,通过将QH缩放到体表面积,Bjorkman预测总QH值与我们的相似(图2)。为了在体重、肝脏重量和QH的离散年龄相关值之间进行插值,使用MATLAB7.0版本(Mathworks,Novi,MI,USA)生成三次样条曲线[图2]。
儿童中未结合的部分往往比成人大,部分原因是由于血浆中两种主要结合蛋白白蛋白和α1-酸性糖蛋白的血蛋白水平降低。在大多数情况下,游离药物分数的值可以在文献中找到以用于测试化合物的模型开发和,然而,这些缩放方法的目的是在没有专门针对儿童产生信息的情况下使用。因此,从成人到儿童的蛋白结合分数是从年龄特异性预测模型得出的,其中未结合的部分与血浆中相对白蛋白和α1-酸性糖蛋白水平相关,并假设与蛋白质的复合亲和力不变,表1总结了用于模型开发和测试的化合物的相关信息,每种清除机制占成人总清除率的相对百分比。
儿童药代动力学数据
从文献中收集儿童药代动力学数据,大多数病例采用静脉给药后获得的清除率数据。然而,当口服生物利用度>95
模型开发
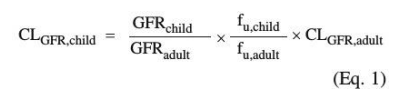
肾脏清除的程度高度依赖于生理参数(如肾血流量、肾血管阻力)和结合蛋白的血浆浓度,以及化合物特异性参数(如蛋白质结合亲和力)。Rubin和Hayton研究了儿童肾小球滤过过程中肾清除的年龄依赖性,肾小球滤过率(GFR)预测是基于63名不同年龄的儿童从2天到12岁的甘露醇清除率。GFR的年龄依赖性本质上包括被测儿童年龄依赖性肾血流量和肾血管阻力。研究发现,这种GFR测量方法适用于>2天大的婴儿,并与该年龄组的菊粉清除率密切相关。对于小于2天的足月婴儿,基于菊粉和庆大霉素的清除率,GFR为3.5mL分钟。对于一般出生体重<3.5kg的早产儿,基于菊粉清除率采用GFR2.0mL/min。采用Hayton方程并进行上述修改,评估儿童GFR。为了计算儿童GFR引起的化合物清除率(CLGFR,child),使用公式1。
GFR方程不包括未结合部分的校正,甘露醇在血浆中的未结合部分大于98
肾脏清除速率超过GFR的化合物也经历小管分泌的活跃过程。Rubin等[55]人研究了儿童小管分泌的年龄依赖性(Hayton[56]进行了综述)。根据63名2天至12岁儿童的对氨基马尿酸(PAH)清除率估计小管分泌。通过GFR消除的PAH从总清除率中减去,产生由于小管分泌的清除率值。PAH是肾脏有机阴离子转运体的底物。由于没有关于有机阳离子转运体的信息,小管分泌的年龄依赖性仅基于PAH清除,对阳离子的推断有明显的局限性。一般来说,肾小管分泌的年龄依赖性被用来衡量与转运蛋白相关的发育过程,并代表净小管分泌。发现成熟半衰期为3.8个月,最初比GFR发育较慢,成熟较慢。[56]使用Hayton公式评估小管分泌比例因子后,[56]使用公式2生成儿童小管分泌引起的肾脏清除率(CLTS,儿童)
TSadult为成人小管分泌率(149mg/min作为成人值,由PAH清[56]除率产生),TSchild为计算的儿童小管分泌率(mg/min)。
肝脏清除率
个体发生模型的发展
肝脏清除的化合物的血浆清除率取决于肝脏的血液灌注、固有清除率、转运过程(例如胆汁排泄、转运体)和蛋白结合的程度。当化合物在肝脏中被清除时,肝酶的发育在血浆清除值的年龄依赖性方面起着重要作用。使用来自文献的体外酶发育信息和/或儿童体内清除研究,建立了许多肝代谢过程的发育模型。
首先,为了开发清除率与年龄的预测模型,需要确定涉及酶的年龄依赖性。首先使用体外文献中的酶活性年龄依赖性数值,这些数值是基于使用探针底物进行的肝微粒体或肝细胞研究得出的,用于描述酶特异性的发育过程。综述文章是这些信息的主要来源。还搜索其他文献,以找到综述中未包含的文章。对于每一项实验研究,儿童与成人肝酶活性是为了在比较研究时不存在绝对值和单位问题。所有的尝试都是为了尽可能多地收集体外活性数据和体内清除率,同时了解研究内部和研究之间普遍存在的高变异性,并对酶的个体发生进行概括。关于这一任务的信息很少。在成人体内药代动力学研究中,性别对CYP底物体外代谢的影响最小,随后对CYP相关代谢的影响也很小。
其次,利用成人体内血浆清除率值以及体重、肝脏重量和肝血流等生理参数,计算成人的内在清除率(见计算内在清除率一节)。根据儿童的年龄和所处理的特定途径,将成人的内在清除率乘以与成人相比的酶活性百分比,该百分比取自体外文献数据。使用相同的方程,虽然重新排列,用成人外推儿童的内在清除率计算。清除率值预测的年龄(从24到36孕周,所有相同的间隙值),任期(37孕周>和<产后24小时)、7天、14天、1个月、6个月,1,2,3,4,5,6,8,10,12,15-20年。然后使用MATLAB7.0版本生成平均清除率与年龄的三次样条曲线。为了评估和发展肝酶个体发生模型,使用儿童初始体外活性值生成的预测年龄与清除率的样条曲线,与观察到的儿童探针底物的体内清除率进行了评估。之所以选择这些化合物,是因为在成人中至少85
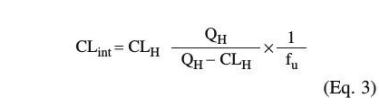
其中QH为肝血流量,CLint为内在肝清除率,fu为血浆中未结合的分数。通过计算所有肝脏代谢过程的总绝对清除率(CLH)[mL/分钟],再加上成人体内未结合的部分(fu,成人),以产生内在清除率(公式3)。然后将CLint归一化为肝脏重量(mL/分钟/g组织),并划定每个代谢过程的内在清除率的比例。根据负责代谢的特定酶的个体发育和模拟儿童的年龄,CLint的比例(mL/min/g组织)根据年龄依赖性酶活性进行缩放。通过使用年龄相关QH(图2)、血浆中未结合分数(fu[6],child)和肝脏重量(图2)重新排列的方程3,计算缩放后的CLint到肝脏清除率。
CYP3A
CYP3A亚家族cypp,代表CYP3A4,CYP3A5和CYP3A7,是最重要的定量代谢酶。在成人中,CYP3A4/3A5负责文献中报道的约一半药物的代谢。[15]在胎儿发育过程中,CYP3A酶含量最多的是CYP3A7,占胎儿肝脏CYP[62]总含量的30-50
CYP1A2
CYP1A2是新生儿出生后最后形成的CYP亚型。[69]CYP1A2活性在胎龄11~24周的胎儿肝脏中不存在。[63]37周龄(胎儿)至10月龄肝组织中CYP1A2蛋白水平仅为2-72岁肝组织中的13
CYP2E1负责相对较少的化合物的代谢。[15]这些化合物包括扑热息痛(对乙酰氨基酚)、氯唑唑酮、酒精(乙醇)和苯。[70]年龄相关的CYP2E1信使RNA和蛋白表达已被广泛研究;然而,活性测量仅限于少数研究。对CYP2E1个体发生的回顾[66]被用作年龄依赖性活性的初步估计。还寻求了其他信息来源。胎儿肝微粒体将扑热息痛氧化为其活性代谢物(由CYP2E1介导),其平均活性约为成人微粒体的十分之一。[71]分娩后,CYP2E1活性和蛋白表达显著增加,并在出生后一年内达到成人水平。[70,72]在0.5~10岁儿童的肝脏中,CYP2E1底物乙氧基香豆素的代谢无年龄相关性差异,其活性与成人相当。[67]由于缺乏CYP2E1特异性底物及其在儿童体内研究中的使用,CYP2E1的个体发生仅基于体外数据(表II)。
Glucuronidation
ugt是人类最重要的II期偶联酶。[15]有超过16种不同的UGT同工酶,每种都具有底物特异性,只有少数被研究了发展趋势。[73]在个体发生方面,研究最广泛的UGT之一是UGT2B7。这种同工酶的内源性底物包括雄酮和表甾酮。[32]外源性底物包括吗啡、可待因、丁丙诺啡和劳拉西泮。[32]体外吗啡检测显示胎儿微粒体UGT2B7活性约为成人肝微粒体的10-20
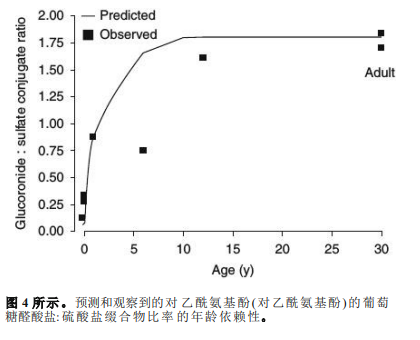
试验化合物扑热息痛是UGT1A6的底物。体外活性水平在胎儿肝脏中较低,在新生儿中略有增加,直到10岁[71,76]左右才达到成人水平(表II)。UGT1A6的个体发生性验证基于上述体外数据,以及在儿童中测定的葡萄糖醛酸盐:硫酸盐结合代谢物比率的数据。正如进一步讨论的那样,对于许多化合物,儿童肝脏中的磺化活性似乎与成人肝脏中的磺化活性相当。硫转移酶和ugt可以共享相同的底物(如扑热息痛和利[71]托[77]卡因)。由于UGT和硫转移酶活性的本体论趋势不同,葡萄糖醛酸盐:硫酸盐代谢物的比例是年龄依赖性的。对于扑热息痛和利托卡因,葡萄糖醛酸盐缀合物是成人的主要代谢物,而在幼儿中,主要代谢物是硫酸盐缀合物。[78,79]在胎儿和新生儿肝脏中,这是由于硫转移酶活性接近成人活性,同时UGT活性较低。[71,77]假设磺化作用不受年龄影响,可以通过体外和体内实验确定的葡萄糖苷:硫酸酯结合物比值图来研究UGT1A6的发育过程,使用对乙酰氨基酚进行实验。
考虑到大多数实验值为1岁以下(n=5个观察值),可以使用这些代谢物间接评估UGT1A6的个体发育。除了6岁时的观察值外,实验值一般可以很好地用预测的葡萄糖醛酸盐:硫酸盐缀合物比率来表示。[82]基于该数据点两侧年龄的较高比率,该值无法解释。
磺化
磺化是一种重要的II期代谢途径,由大约11种同工酶催化。[72,83]磺化转移酶SULT1和SULT2代表了那些对药物代谢最重要的家族。[83]已经研究了一些同工酶的硫转移酶个体发生,这些同工酶比较了成人和胎儿的活性。[73,84]虽然硫酸化是同工酶和底物特异性的,但胎儿似乎具有大量的硫酸化能力,[73,83,84],尽管缺乏关于出生后早期以后硫转移酶活性的信息。用于体内研究的探针底物很少[85],在儿童中也没有发现相关数据。从给予扑热息痛的婴儿(6-16个月)的体内清除率数据来看,与成人相比,该年龄组体重标准化磺化清除率似乎没有差异。[81]其他人也发现了类似的结果。[78]根据这些信息,为了将清除率推广到儿童,磺酰转移酶活性并不被认为是年龄相关的。当有额外信息可用时,可以轻松地将其纳入模型中。
胆汁排泄
很少有成人研究,也没有儿童研究,其中胆道清除是消除的主要组成部分。因此,胆道排泄的个体发生是基于大鼠模型[86,87]中的胆道排泄功能和人类婴儿的间接测量。[87]在新生大鼠中,血清胆汁酸浓度升高和肝脏摄取减少已被证明会导致早期肝脏排泄效率低下。[86,87]此外,在人类婴儿中,腔内胆汁酸浓度降低表明分泌功能不成熟。[87]基于这一有限的数据,使用四分之三功率异速大小模型对儿童的胆道清除率进行缩放,并按肝脏重量缩放。该幂函数用于描述分形分支网络(在本例中为胆管)的有效内表面积代表,如West等人所描述的。对于<3个月大的儿童,胆汁排泄从三分之四肝脏重量缩放方程产生的值中减少了新生儿的四分之一,1周至3个月的婴儿减少了一半。所有得到的胆道清除率都乘以儿童/成人未结合分数的比率。
模型的假设这种间隙缩放方法基于以下假设:
- 平均成人清除率值适合描述大多数健康成人,并用作固定值;
- 每种清除机制对总清除率的相对贡献是正确的;
- 所有化合物在肝脏中保持良好的搅拌条件,使得肝脏中的摄取动力学由血流决定,而不是通过细胞膜的渗透过程;
- 酶动力学在线性范围内,因此饱和过程被认为不会发生;
- 血液:血浆比率在成人和儿童之间足够相似,证明使用血浆是合理的
血浆清除率与公式3中的血液清除率相反;
- 如果肝脏转运蛋白在清除中发挥作用,则由于没有考虑转运蛋白的个体发生,因此在成人和儿童中假定转运蛋白/酶的相互作用相同。转运蛋白的个体发生尚未得到重要的研究。
模型评价
为了评估个体发生模型的预测性,使用六种具有多种清除机制的测试化合物(芬太尼、茶碱、扑热息痛、环丙沙星、利多卡因和丁丙诺啡)的数据作为测试数据集。这些化合物的选择是基于文献数据填充特定标准的能力(参见所需的先验信息一节)。观察到的清除值也必须适用于儿童。对其他化合物进行了检查,由于缺乏关于每种清除途径对总清除率的贡献的信息(例如安替比林、奎尼丁、天尼泊苷),大多数化合物被丢弃。对于试验化合物,根据其对成人总清除率的贡献,将其在成人中的总清除率划分为各自的清除途径。每种清除途径对儿童的影响都相应地进行了缩放(见图1和方法开发程序概述部分)。儿童的总血浆清除率是每种化合物的肾、肝和胆道血浆清除率贡献的总和(见图1)。为了确定预定义的个体发育模型或方程预测观察清除率的能力,确定了模型开发和测试化合物的观察清除率和预测清除率之间的相关性,以及[89]偏差和精度测量(观察值的百分比内的值的百分比)。在测试期间,在模型开发期间推导的数学模型不允许有任何变化。
结果
对于肾脏清除率,hay[56]ton提供的GFR方程(并针对更年幼的儿童进行了修改)适用于描述庆大霉素和异帕霉素的年龄依赖性清除率(图3a和3b)。没有化合物可用于评估小管分泌Hayton[56]equation的准确性。对于肝酶,估计的个体发育比例因子列于表II。这些值与文献中的值相似,略有变化(CYP2E1除外,其仅基于体外数据)。这些变化在不同研究中相对活度与成人活度的文献值相关的变异性内。它们代表了在每个过程中(在CP3A4,CYP1A2和UGT2B7的情况下)两种模型发育化合物的观察和预测年龄相关清除率之间产生最佳视觉拟合的值。对于通过磺化和胆道排泄的清除,没有模型发育化合物可用。将每种测试化合物的清除率预测值
与文献值进行比较(表III和图5)。图6显示了模型发育化合物和测试化合物在儿童中预测和观察到的清除率值之间的总体相关性。总的来说,本研究中研究的药物覆盖了0.07-60mL/min/kg的宽清除率范围,预测成人与儿童的最大和最小清除率分别约为1:2.5(阿芬太尼)和1:0.03(劳拉西泮)。对于模型开发集,决定系数R2=0.979(n=76个间隙值),偏差为0.0395
mL/min/kg(95
讨论
年龄对药物清除的重要性在过去得到了广泛的研究。[12,56,66,176,177]新生儿体重正常化清除率通常低于成人,在出生后的一两年内超过成人水平,并在20多岁时逐渐下降到成人水平。这一趋势在本研究中检测的所有化合物中都很明显。早产儿的清除率通常远低于成人。随着发育成熟,儿童体重正常清除率超过成人。清除率达到最大值的年龄,以及峰值的最大值和宽度,因各种消除过程而异。这表明了解儿童药物使用中清除个体发生的重要性,因为清除是治疗反应的关键调节因素。最近,来自Bjorkman[12]andAlcorn和McNamara的关键论文评估了清除率的年龄依赖性。[177]Alcorn和mcnamaraf[66]ur进一步提供了体外酶个体发生的优秀文献综述。在大多数情况下,所回顾的研究中的清除率预测是足够的,尽管没有产生定量测量。清除率对足月新生儿至6个月[177]或足月新生儿至成人进行了分级。[12]两项研究均使用Hayton公式将肾脏清除率的个体发生限制为GFR。对于肝酶[56]促个体发生,体外微粒体个体发生研究形成了肝脏分级的主要基础间隙。Alcorn和mcnamaraf[177]ur进一步使用了从体外到体内的外推技术。这两项研究都表明,需要更广泛的模型开发/验证来产生可靠的清除率测量。本研究中讨论的缩放方法扩展了这两项研究中处理的概念,并进一步提供了一种更广泛和可靠的缩放方法。所有年龄段的儿童,包括早产儿,都可以用这种方法预测清除率。为此,肝脏酶促个体发生和生理变化的检查是通过使用体外活性测量和儿童体内清除来确定的,使用的化合物大部分消除是由于一个过程。通过了解每个消除过
程的个体发生并生成儿童的总清除率值,可以实现四个数量级以上的清除率预测,并且观测值和预测值之间具有良好的相关性(模型开发集,R2=0.979;测试集,Q2=0.927),无显著偏倚,>83
在儿科人群中观察到的清除率值的个体间变异性非常大,在大多数情况下,大于在成人中观察到的变异性。部分原因可能是,在一些研究中使用的年龄范围太广,导致对特定年龄清除率的分辨率下降(见吗啡,图3g)。另外,当年龄范围被限制在非常年轻的个体,只有几天到几个月的损失由于在此期间迅速变化的成熟,解决发生了(见吗啡,图3g)。实验研究将受益于研究广泛的年龄范围,但它们应该在足够小的年龄范围内进行分析,以检查与年龄相关的变化,特别是从出生到1岁的代谢清除化合物。这对于那些使用清除率值作为剂量调整手段的人来说是有益的。近年来,美国FDA以及欧洲监管机构施加的压力越来越大制药业应加大努力,为儿科人群中新开发和目前已上市的药物提供临床数据。[180,181]不同年龄组的药代动力学特征(如果适用的话,药效学)始终是临床开发的第一步。这些药代动力学试验的准备工作也可以通过指导研究中每个年龄范围的起始剂量来预测清除率。与成人相比,6个月至12岁的儿童可能需要增加体重正常化剂量,以达到所需的血药浓度时间曲线。小于6个月的儿童可能需要更少的剂量,而12岁以上的儿童则需要与成人相似的剂量。包括化合物特异性成人:儿童清除率的有针对性的临床试验将需要更少的儿童来获得所需的药代动力学和药效学信息。此外,通过药代动力学标度来满足儿童的需求是风险评估、了解潜在的药物-药物相互作用和治疗的有用工具剂量比例。保护儿童免受环境中存在的化合物侵害的风险评估纳入了这样一种认识,即儿童药代动力学和药效学过程的改变会影响不良反应的可能性。[176,182,183]与成人相比,儿童的药物-药物相互作用可能不同,因为每种消除途径对总清除率的贡献可能存在年龄相关的变化。预测这些相互作用程度的能力取决于对清除途径和参与消除的每种代谢酶的个体发生的理解。存在许多其他酶负责药物消除。这些酶包括I期酶,如酯酶、醇脱氢酶、含黄素的单加氧酶、环氧化物水解酶和更多的CYP酶。其他II期过程包括谷胱甘肽和甘氨酸偶联,n-乙酰转移酶以及本研究中讨论的许多其他UGT和硫基转移酶。[63,73]在体外和体内的缺乏旨在发现这些过程的个体发生的研究限制了它们在清除率预测中的应用。持续的实验将增加酶的个体发生数据库和清除缩放的范围。
结论
虽然没有什么可以替代在儿童中进行的良好的药代动力学/药效学和药代动力学研究,[184]但对儿童的清除率进行缩放将提供对剂量的初步估计,特别是与分布体积缩放相结合,[185]并进一步了解药物-药物相互作用的发展程度。
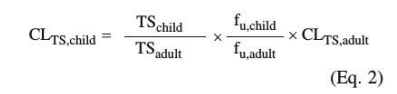

文章评论
你好,也在学习PBPK方面的内容, 看您从CSDN转到了自建的网站,不知道能不能加个微信好友?谢谢。
您好,我也想加个好友。182-23-0-5-19-4-5