伦理法规限制和儿科受试者招募困难是导致单克隆抗体儿科适应症获批中位延迟 6 年的关键挑战。为突破这些障碍,建模与模拟方法已被用于设计优化的儿科临床研究并减轻患者负担。目前监管申报中儿科药代动力学研究的经典建模方法是基于成人群体药代动力学(popPK)模型参数,通过体重或体表面积异速缩放法推算儿科给药方案。但该方法难以充分反映儿科人群(尤其是低龄婴儿)快速变化的生理特征。为此,能够考虑儿科关键生理过程个体发育特征的生理药代动力学(PBPK)建模正成为替代策略。尽管已发表的单抗 PBPK 模型数量有限,但英夫利昔单抗儿科案例研究表明,PBPK 建模预测精度与 popPK 建模相当,展现出巨大应用潜力。 为促进未来 PBPK 研究,本综述整合了儿科单抗处置关键生理过程发育特征的全面数据。最后,本文探讨了群体药代动力学模型与生理药代动力学模型的不同应用场景,以及二者如何互补提升药代动力学预测的可信度。
在过去的几十年里,治疗性单克隆抗体(mAbs)领域的新发展已使其成为多种成人疾病治疗的主要手段,目前有超过 110 种单克隆抗体获得美国食品药品监督管理局(FDA)或欧洲药品管理局(EMA)批准( Table S1 )。然而获批用于儿科适应症的单克隆抗体不足 40 种( Table S1 ),但 mAbs 在儿科疾病治疗中的效用已逐渐获得认可。最近,bamlanivimab(LY-CoV555)和 REGN-COV2 被用于治疗 12 岁以上儿童的 SARS-CoV-2 感染。随着 FDA《儿科研究公平法案》(PREA)的出台以及卫生部门为鼓励儿科研究提供的资助激励,开发针对儿科疾病的单克隆抗体迎来了新的机遇。
尽管人们对开发用于儿科治疗的 mAb 兴趣日益增长,但伦理法规和有限的儿科受试者仍是阻碍儿科临床试验的关键障碍[ 7 ]。这些关键挑战导致 mAb 治疗获批儿科适应症的中位延迟时间为 6 年[ 8 ]。为克服这些障碍,制药行业越来越多地采用建模与模拟方法学来设计优化的儿科临床研究并减轻患者负担[ 9 、 10 ]。例如,通过建模与模拟可将成人的药代动力学数据外推至儿科群体,从而为临床试验中平衡疗效与安全性的儿科首次剂量选择提供依据[ 11 、 12 、 13 ]。此外,从监管角度来看,FDA 已认可建模与模拟方法学的应用价值,并强烈建议在儿科研究计划(PSP)申报中纳入这些方法学[ 14 ]。本微型综述旨在评估儿科 mAb 药代动力学预测的经典建模方法及其相关知识缺口。 基于此背景,本微型综述探讨了基于生理学的药代动力学(PBPK)建模这一新兴替代方法如何有效弥合相关认知空白。
2.1. 儿科单抗药物研发中建模与模拟方法学的比较
本研究通过 PubMed 平台开展系统性文献检索,系统梳理不同建模方法学的特征属性。检索关键词包括"群体药代动力学建模""popPK 建模""基于生理的药代动力学建模""PBPK 建模"及"异速生长缩放"。为聚焦儿科领域与单克隆抗体研究,同时加入"儿科""儿童""婴儿""单克隆抗体""mAbs"等限定词。此外,通过 FDA 药物数据库调研单抗药物研发中最常用的建模方法学,并审阅已获批儿科单抗药物的生物制品许可申请(BLA),汇编监管申报中所采用的建模方法学体系。
2.2. 用于儿科 PBPK 模型开发的生理参数年龄依赖性筛选
PubMed 用于筛选单克隆抗体儿科 PBPK 模型开发中重要的生理参数个体发育情况,使用的关键词包括"新生儿"、"婴儿"、"幼儿"、"儿童"、"青少年"和"儿科",同时结合了相关关注的生理参数。通过人工筛选包含儿科生理参数全面数据集的关键研究文章的参考文献列表,以寻找相关参考文献来验证我们的数据集。
2.3. 儿科 PBPK 建模研究分析
鉴于已发表的单克隆抗体(mAbs)PBPK 研究有限,我们使用关键词“儿科 PBPK 模型”和“单克隆抗体”或“mAbs”在 PubMed 进行了广泛检索。随后,为筛选针对特定单克隆抗体的儿科 PBPK 模型,在上述关键词检索基础上结合已获批用于儿科治疗的现有单克隆抗体进行筛选。仅保留同时报告预测 AUC 及可计算 AUC 的实测血清浓度-时间图的研究。通过 Graph Reader(v. 4.0,阿斯利康,英国剑桥)对血清浓度-时间图进行数字化处理,并采用 R 软件(v. 4.2.2,核心团队,奥地利维也纳,2022)计算 AUC。Microsoft ® Excel ® (v. 2208,Microsoft Office,美国华盛顿特区)用于图表绘制及倍数变化可视化。
3.1. 儿科给药方案的经典建模方法
用于外推首次儿科剂量的建模与模拟方法涵盖从基于体型的异速缩放到更复杂的生理药代动力学(PBPK)建模及群体药代动力学(pop-PK)建模等多种技术。这些方法的优势与局限已在 Table 1 中进行了总结。
基于体重从成人到儿童进行异速缩放以确定给药方案可能适用于单克隆抗体(mAb),其中药代动力学(PK)主要与体重相关且呈现线性特征。然而,当 mAb 清除率不随体重线性变化时,基于体重的给药方法可能导致低体重组儿童获得的剂量在临床上处于次优水平。因此,在临床实践中,异速缩放很少单独应用于已获批单克隆抗体的儿科给药方案制定,而是与群体药代动力学(popPK)建模等更具科学严谨性的方法相结合,以确定儿科人群安全有效的单克隆抗体暴露水平。
PopPK 利用数学模型评估来自不同临床研究的汇总 PK 数据。协变量信息(体重、年龄或性别)可被整合至 popPK 分析中,这有助于解释人群内的 PK 变异性。该方法的主要优势在于能够分析稀疏数据(儿科研究的典型特征),并识别和纳入影响 PK 的协变量,从而促进儿科剂量选择。例如,体重是 popPK 建模中常纳入的协变量,因为已证实它会显著影响 mAb 的 PK。
尽管群体药代动力学(popPK)模型常被用于支持儿科临床试验设计,但其捕捉儿科患者生理变化复杂性及单克隆抗体(mAb)对药代动力学(PK)影响的能力仍存在局限。虽然可在 popPK 模型中纳入基于胎龄与出生后年龄总和的 S 型成熟函数来阐释儿科与成人间的成熟差异,但必须认识到儿童并非缩小版成人。越来越多证据表明,基于体重的异速缩放无法反映儿科成长过程中复杂的发育进程,尤其在低龄群体中更为显著。多项研究证实,幼儿快速变化的生理状态可能影响 mAb 的药代动力学特征:例如出生后细胞外液容量迅速减少,而血浆容量逐渐增加,导致可供单克隆抗体分布的总体积比例更高。 虽然群体药代动力学(popPK)建模中的异速生长缩放法能够解释成人与儿童之间的体型差异,但其未涵盖上述儿童生理功能的个体发育特性、,这仍是儿科单克隆抗体研发中 popPK 建模的主要局限性。鉴于儿科人群(尤其是低龄婴儿)易受剂量错误引发的副作用影响,建模与模拟方法必须充分考虑儿科与成人生理差异如何影响单克隆抗体的药代动力学特性及相应的药物暴露水平。
3.2. 基于生理学的药代动力学模型——一种新兴的替代方法?
为克服群体药代动力学(popPK)建模的局限性,研究采用能够反映关键生理过程个体发育特征的生理基础药代动力学(PBPK)模型来确定儿科临床试验的首剂剂量。该模型通过微分方程组描述由血流连接的特定组织所构成的房室系统,从而精准模拟从新生儿到成人的人体解剖结构与生理特征。在此基础上,整合儿科生理学中血流、淋巴循环及生化反应等个体发育参数,可系统评估这些因素对药物暴露量的影响。
PBPK 建模研究在监管机构(如美国 FDA 和 EMA)的监管申报中已成功应用于小分子药物领域,其作用已得到充分验证。然而,由于小分子药物与大分子药物(如单抗)的药代动力学特性存在本质差异( Table 2 ),不能直接假设 PBPK 模型在单抗药物开发中也能取得相同成效。因此,需专门评估 PBPK 模型在儿科单抗药物研发中的适用性。
3.3. 儿科单克隆抗体处置关键生理过程的个体发育及其在 PBPK 研究中的探索方向
为阐明 PBPK 研究如何探索儿科单克隆抗体处置关键生理过程的年龄依赖性特征,我们整合了从新生儿至成人不同年龄阶段的生理数据( Table 3 ),并重点引述了近期评估该领域认知水平的综述文献中的若干重要发现。
鉴于单克隆抗体分子量较大、膜渗透性较差的特点,其分布主要局限于血浆和细胞外液。因此,可利用血浆及细胞外液容量估算单抗的分布容积。临床研究观察到,细胞外液自出生后快速减少(尤以最初数月显著),结合血浆容量从出生起缓慢增加的趋势,幼儿群体的总体分布容积较成人呈现更高水平。
尽管单克隆抗体在儿科中的外渗尚未量化,但具有相似分布模式和 FcRn 亲和力的其他血浆蛋白(如白蛋白)的外渗率可作为探索单克隆抗体外渗个体发育的替代指标。研究报道新生儿血浆蛋白外渗率高于成人,表明单克隆抗体可能存在类似趋势。解释血浆蛋白外渗率升高的潜在机制可能包括:与成人相比,婴幼儿体内"渗漏"组织(毛细血管通透性较高的组织)比例更高,以及毛细血管密度更大。
儿科药代动力学研究亦报告了婴儿对治疗性蛋白的吸收率高于成人。由于单克隆抗体的主要吸收途径是淋巴引流与再循环,淋巴液流速可作为其吸收速率的参考指标。尽管目前尚未对婴儿群体的淋巴流速进行量化研究,但通常预估其值为血浆流速的 0.2
单克隆抗体的主要消除途径是通过内吞作用后的溶酶体降解,临床证据已表明 Fc 新生儿受体(FcRn)在保护单克隆抗体免于溶酶体降解中起关键作用。血管内皮中约 66
与成人相比,儿科患者中 FcRn 表达水平较高的这一新发现反驳了 Malik 等人先前提出的假设,即儿科患者中较低的 FcRn 表达水平可能是导致低龄婴儿单克隆抗体清除率升高的原因。但需注意该假说的局限性:低龄婴儿单克隆抗体清除率升高也可能源于其出生后内源性 IgG 浓度较高,导致 IgG 与单克隆抗体对 FcRn 结合的竞争加剧。因此,单克隆抗体与 FcRn 结合的减少可能解释了单克隆抗体的 FcRn 再循环减少,从而导致其清除率升高。目前,单克隆抗体清除率的升高不能归因于单一变量,而应更准确地解释为多变量共同作用的结果。因此,探索参与单克隆抗体清除的不同生理过程的年龄依赖性可为该领域提供更深入的见解。
3.4. 现有儿科 PBPK 模型对单克隆抗体的展望
对已发表的儿科单克隆抗体 PBPK 建模研究进行了分析,以评估现有 PBPK 模型的预测准确性。然而,尽管越来越多研究者认识到其在解释儿科生理个体发育如何影响单抗药代动力学(PK)方面的重要作用,目前针对单抗的儿科 PBPK 研究仍十分有限。迄今为止仅发表了七个儿科 PBPK 模型,相较于当前获批用于儿科治疗的 39 种单抗,这些儿科 PBPK 研究仅覆盖不足 10 种单抗。造成这一现象的原因可能在于:一方面,关于单抗 PK 的年龄相关性变化及儿科生理个体发育数据的知识匮乏,制约了需要丰富生理学知识支撑的 PBPK 模型开发。
就 PBPK 模型研究而言,英夫利昔单抗(Infliximab)是研究较为充分的单克隆抗体之一。Pan 等构建了涵盖足月新生儿至青少年群体的英夫利昔单抗 PBPK 模型。以该 PBPK 研究为例,我们评估了不同儿科年龄组间 PBPK 预测准确度的差异,通过预测的曲线下面积(AUC),以预测值/观测值比率作为预测准确性的衡量指标。本研究中,所有儿科年龄组的 PBPK 建模预测准确度均处于 0.5-1.5 倍变化范围内( Figure 1 ),表明其具有合理准确性。同一研究中,采用群体药代动力学(popPK)参数进行的异速缩放分析也发现,英夫利昔单抗预测平均清除率值均落在观测数据的 2 倍范围内。Malik 等的研究结果也支持上述结论,其报道称针对 4 岁以上儿童的英夫利昔单抗 PBPK 模型预测浓度值有 66.7
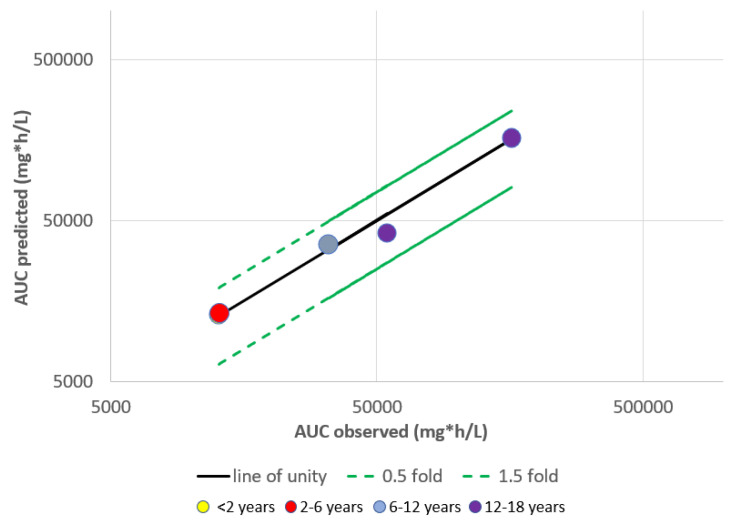
尽管英夫利昔单抗的生理药代动力学(PBPK)建模研究已取得显著进展,但同一 PBPK 模型并不能确保在其他单克隆抗体及疾病状态下获得相似的成功。未来 PBPK 研究应扩大范围,纳入其他已批准用于儿科的单克隆抗体,但需以临床数据的可获得性作为 PBPK 模型开发前提。基于前述英夫利昔单抗案例研究所建立的 PBPK 模型开发通用流程详见 Figure 2 ,该框架可被"适配"用于其他单克隆抗体的儿科 PBPK 模型开发。未来 PBPK 研究可探索的另一方向是考量不同疾病状态下靶受体表达的差异性,鉴于靶点介导的药物处置仍是单克隆抗体主要消除途径之一。
然而,PBPK 建模面临的最大挑战之一是个体发育数据仍处于不断更新阶段,通常需要做出假设来弥补个体发育数据的不足。例如,由于缺乏儿科患者 FcRn 丰度数据,上述研究不得不假设 FcRn 与 IgG 之间存在相关性,从而探究儿科患者 IgG 半衰期的变化轨迹。为提高现有 PBPK 模型的可信度,这些假设需通过临床数据进一步验证。然而,出于伦理考量及样本量限制,儿科临床数据的收集存在固有局限性。因此,PBPK 研究应着力利用更易获取的体外到体内外推(IVIVE)数据,并开发最佳实践以最大程度减少预测准确性的折损。借助 IVIVE 技术,对生理过程个体发育的初步探索可为未来儿科研究提供具有临床意义的个体发育线索,从而减轻临床研究中患者的负担。 单克隆抗体(mAb)的 IVIVE 技术已取得重大进展,使得体内单抗清除率与 FcRn 结合亲和力以及 FcRn 依赖性转胞吞作用之间的相关性得以探索。由于儿科临床数据仍然稀缺,优化 IVIVE 技术可能是将体外实验数据转化为可靠体内外推的解决方案。
通常,群体药代动力学(popPK)模型已被广泛用于向美国食品药品监督管理局(FDA)和欧洲药品管理局(EMA)提交单克隆抗体(mAb)的监管审批申请,并已证明其在解释单抗临床 PK 数据变异性来源方面的有效性。然而,很少有 popPK 分析纳入新生儿和婴儿的单抗 PK 数据,大多数儿科 popPK 研究招募的是 6 岁以上的较大儿童和青少年。此外,有研究报道,将基于体型的异速生长缩放方法应用于 popPK 模型时,通常在到达较低年龄组之前效果良好。因此,当前的单抗给药方法是否对低龄婴儿安全有效仍有待评估,尤其是考虑到出生至 2 岁期间会发生显著的生理变化[ 31 ]。在这种情况下,基于生理的药代动力学(PBPK)模型可能很有价值,可纳入低龄婴儿儿科生理的个体发育因素,从而增强对 popPK 模型 PK 预测结果的信心。
虽然 PBPK 模型展现出巨大潜力,但仍存在一些局限性需要考虑。例如,儿科 PBPK 模型的可靠性在很大程度上取决于基础生长发育数据。在缺乏生长发育数据的情况下,研究人员采取了实用主义尝试——通过类比内源性蛋白与治疗性蛋白的 PK 数据来弥补 FcRn 生长发育数据的缺失。然而,由于这种方法基于假设,仍存在残留不确定性。此外,PBPK 模型的开发和验证需要大量详实数据支撑,导致其构建过程漫长而艰巨;因此,与经验性群体 PK 模型相比,PBPK 模型在儿科研究中的应用相对较少。
最终,使用哪种建模方法应基于具体的研究问题。例如,靶点负荷较高的单抗(如曲妥珠单抗)常因 TMDD 呈现非线性 PK。然而,目前尚无可靠方法通过异速缩放法对非线性 popPK 模型的 TMDD 进行比例缩放。在这种情况下,当考虑 TMDD 时,PBPK 模型的建模能力将极具优势。
同样重要的是要牢记,建模方法并非相互排斥,异速缩放、群体药代动力学(popPK)和生理药代动力学(PBPK)可协同使用。如前所述,异速缩放结合 popPK 建模是向美国食品药品监督管理局(FDA)和欧洲药品管理局(EMA)提交单克隆抗体(mAb)监管审批申请中的经典方法。然而,在商用软件 SimCYP(Certara 公司旗下 SimCYP 有限公司,英国谢菲尔德)中,异速缩放也与治疗性蛋白质的 PBPK 建模相结合。例如,儿科的血流量和器官体积是通过成人参考值进行异速缩放得出的。此外,在缺乏个体发育数据时,异速缩放尤其有用。例如,目前尚未量化儿童淋巴流量的数据,但文献研究支持淋巴结数量在儿童期减少这一事实。因此,PBPK 研究已探索采用 0.75 的异速缩放指数对淋巴流量进行缩放,并以成人 3.855 mL/h/kg 作为参考值。 尽管认识到这种方法可能会产生残余不确定性,但它是一种实用方法,允许在 PBPK 研究中探索假设。一旦未来临床数据出现以弥补现有个体发育数据的不足,PBPK 模型可进一步优化以提高预测准确性。
总之,群体药代动力学(popPK)建模通常适用于 6 岁以上的较大儿童。然而,新生儿和低龄婴儿群体药代动力学研究的缺失确实引发了疑问——该模型是否仍是针对低龄婴幼儿与新生儿的金标准方法。特别是当低龄婴儿存在显著生理变化时,基于生理的药代动力学(PBPK)建模作为一种机械性自下而上的方法,能够解释低龄婴儿的生理变化,有望成为建模与仿真方法体系中的有力工具。虽然儿科单克隆抗体的 PBPK 建模仍处于发展初期,但上文讨论的英夫利昔单抗(Infliximab)案例研究取得的初步成功表明,它有望成为经典 pop-PK 建模方法的补充,增强预测结果的可信度。在回答不同研究问题时,pop-PK 或 PBPK 各有优势,关键在于识别何时应用这些建模方法。最终,随着对儿科单克隆抗体内药代动力学机制理解的深化,不同方法论间的边界划分也将持续演进。 因此,针对特定年龄组规定使用某种特定方法可能为时过早,因为在回答具体研究问题时,需要综合考虑与人群系统参数(包括年龄范围)相关的药物特性。
文章评论